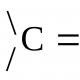Чим відрізняються моно та полісахариди. Глікозидний. Зернові та бобові
Ціль заняття:вивчення будови та хімічних властивостей вуглеводів та їх роль в організмі.
Студент повинен знати:
- знати будова, різні види ізомерії моносахаридів та їх похідних;
- хімічні властивості моносахаридів та їх похідних;
- Реакції, що лежать в основі катаболізму глюкози - гліколіз;
- будова та властивості дисахаридів та полісахпридів;
- хімічні властивості дисахаридів та полісахпридів.
Студент повинен уміти:
- пояснити кільчасто-ланцюгову таутомерію, конформаційну ізомерію, оптичну ізомерію, кислотно-основні властивості моносахаридів, їх окиснювально-відновлювальні властивості;
- пояснити різницю у структурі відновлювальних і невосстанавливающих цукрів, причини цього явища.
Вуглеводи (ув)
Найважливіший клас органічних сполук, що у природі. Найбільш відомі глюкоза, крохмаль, целюлоза, глікоген, гепарин та ін, що грають важливе значення в життєвих процесах людини та тварин.
УВ - група природних речовин, що відносяться до поліоксикарбонільних сполук, а також речовини, близькі їм за будовою.
У номенклатурі УВ широко використовують тривіальні назви: рибоза, фруктоза тощо.
Моносахариди (мс)
Ізомерія
Наявність кількох асиметричних атомів вуглецю обумовлює існування значної частини оптичних ізомерів. Це і енантіомери (дзеркальні ізомери, антиподи), і діастереомери, епімери. Епімери – це діастереоміри, що відрізняються один від одного конфігурацією тільки одногоасиметричного атома С. Всі ізомери, крім дзеркальних, відрізняються один від одного властивостями та мають свою назву:
Приналежність МС до D- або L-ряду визначається конфігурацією останнього (найбільш віддаленого від  гр.) хірального атома С за аналогією зі стандартом – гліцериновим альдегідом:
гр.) хірального атома С за аналогією зі стандартом – гліцериновим альдегідом:
|
|
|
Природні цукру - D-цукор, L-цукор надходять в організм ззовні.

 Знову утворений гідроксил зветься напівацетального, або глікозидного і може по-різному розташовуватися в просторі щодо циклу, утворюючи ще один асиметричний атом вуглецю в циклічній формі. Якщо напівацетальний гідроксил розташовується по одну сторону з гідроксилом, що визначає приналежність до D- або L-ряду, такий ізомер називається a-ізомером, а інший - b-ізомером. Стереоізомери, що відрізняються один від одного розташуванням тількинапівацетального гідроксилу в просторі, називаються аномерами.
Знову утворений гідроксил зветься напівацетального, або глікозидного і може по-різному розташовуватися в просторі щодо циклу, утворюючи ще один асиметричний атом вуглецю в циклічній формі. Якщо напівацетальний гідроксил розташовується по одну сторону з гідроксилом, що визначає приналежність до D- або L-ряду, такий ізомер називається a-ізомером, а інший - b-ізомером. Стереоізомери, що відрізняються один від одного розташуванням тількинапівацетального гідроксилу в просторі, називаються аномерами.
Процес утворення циклічних форм називається аномеризацією. Циклічна та відкрита форми легко переходять одна в одну і перебувають у динамічній рівновазі. При кімнатній температурі переважає циклічна, при нагріванні відкрита. Для альдогексоз більш характерна піранозна форма, для пентоз і фруктоз – фуранозна. Усе це відбивається у назві, наприклад, a-D-глюкопіраноза. У кристалічному стані циклічні форми закріплені і a-, b-ізомери стабільні і можуть бути відокремлені один від одного. При розчиненні частина молекул перетворюється на відкриту форму, та якщо з неї утворюються всі види циклічних форм. Оскільки кожна форма має власний кут обертання променя поляризованого світла, до встановлення динамічного рівноваги кут обертання постійно змінюватися. Зміна в часі кута обертання площини поляризації світла свіжоприготовленого розчину вуглеводів називається мутаротацією.
Нині замість циклічних формул Коллі-Толленса найчастіше користуються перспективними формулами Хеуорса.
Саме циклічна форма беруть участь в утворенні ді- та полісахаридів.
Хімічні властивості
Циклічна та відкрита (альдегідна) форми перебувають у рівновазі. Тому можливі р-ції, характерні для альдегідної та циклічної форм.

Всі моносахариди взаємодіють з НСN, РС1 5 , NH 2 OH, NH 2 -NH 2 , NH 2 -NHC 6 H 5 окислюються, відновлюються (Н 2)
Залежно від характеру окисника та реакції середовища МС можуть утворювати різні продукти окиснення.
1. При дії слабких окислювачів: Аg 2 O, NH 4 OH, to або Cu(ОН) 2 , ВІН - , to йде руйнування вуглець-вуглецевого ланцюга з утворенням оксикислот з невеликим числом атомів, а самі окислювачі при цьому відновлюються до Аg і Сu 2 O(Cu) відповідно. Р-ція знаходить застосування у біохімічних аналізах для кількісного визначення цукрів у біологічних рідинах.
Р-ція Толленса:
"Люстерко"
Р-ція (проба) Тромера:
При обережному окисленні в кислому водному середовищі, наприклад, бромною водою, утворюються к-ти за рахунок окислення альдегідної групи - альдонові кислоти:
При дії сильних окислювачів йде окислення по першому та шостому атомам С з утворенням арових к-т:
При окисленні тільки первинної спиртової групи (по 6-му атому С), якщо альдегідна група захищена з утворенням глікозиду, отримують уронові к-ти. В організмі цей процес легко під дією ферментів. Уронові к-ти здатні до цикло-оксо-таутомерії. Вони є важливою складовою кислих гетерополісахаридів, наприклад, гепарину, гіалуронової к-ти.
Р-ции по спиртовим гидроксилам протікають як і відкритої, і у циклічних формах.
МС взаємодіють із Ме, Ме(ОН) 2 , утворюючи сахараты, з Сu(OH) 2 , з СН 3 I із заснуванням простих ефірів, з мінеральними і органічними к-тами утворюються складні ефіри, з NH 3 – аміносахара.
Найбільш важливі фосфорні ефіри цукрів та аміносахара. Саме у вигляді фосфорних ефірів рибозу та дезоксирибозу входить до складу НК, сполуки глюкози та фруктози беруть участь в обміні речовин.

Фруктоза + 2Н 3 РО 4 1,6-дифосфат фруктози.
Аміносахара в організмі утворюються досить легко у процесі аммонолізу. Найчастіше по другому атому С:

Аміносахара є складовою гетерополісахаридів.
Р-ції по напівацетальному гідроксилу
Ці р-ції притаманні циклічної форми. При дії на моноцукор спирту в присутності газоподібного НС1 відбувається заміщення атома Н напівацетального гідроксилу на R з утворенням особливого типу простого ефіру - глікозиду. Розчини глікозидів не мутаротують. Залежно від розміру оксидного циклу глікозиди діляться на: піранозиди та фуранозиди, як a-, так і b-форм.

Утворення глікозидів є доказом існування циклічних форм моносахаридів.
Перетворення моносахарида на глікозид – складний процес, що протікає через низку послідовних р-цій. Внаслідок таутомерії та оборотності р-ції утворення глікозиду в р-рі, у рівновазі в загальному випадку, можуть бути таутомерні форми вихідного моносахариду і відповідно 4 діастереомерних глікозидів – a та b-аномери фуранозидів та піранозидів.
Глікозиди можуть також утворюватися при взаємодії з фенолами або NH, що містять аліфатичними та гетероциклічними амінами.
Молекулу глікозиду формально можна уявити що складається з двох частин: вуглеводної та агліконової. У ролі гидроксилсодержащих агіконів можуть і самі моносахариды. Глікозиди, утворені з ОН–содержащими агліконами, називаються О-глікозидами, з NH-содержащими сполуками (наприклад, амінами), наз-ся N-глікозидами.
Глікозиди є складовими частинами багатьох лікарських рослин. Наприклад, серцеві глікозиди, виділені із наперстянки. Антибіотик – стрептоміцин – глікозид, ванілін – глікозид. Всі ді- та полісахариди є О-глікозидами.
З біологічної точки зору особливе значення мають N-глікозиди рибози та дезоксирибози, як продукти сполуки з азотистими пуриновими та піримідиновими основами. Їхня загальна назва – нуклеозиди, т.к. разом із Н 3 РО 4 є нуклеїновими к-тами – ДНК і РНК.
Всі глікозиди, у тому числі нуклеозиди, легко піддаються гідролізу в кислому середовищі з утворенням вихідних продуктів.
Глікозиди не здатні до цикло-оксо-таутомерії та виявляють р-ції, характерні для спиртів.
IV. Специфічні р-ції
Дія розб. розчинів лугів
Епімери: глюкоза, фруктоза та манноза легко перетворюються один на одного, утворюючи рівноважні системи. Цей процес називається епімерізацією.
дія конц. р-рів к-т
Конц. розчини НС1 і Н 2 SО 4 викликають дегідратацію моносахаридів: з пентоз утворюється фурфурол, з фруктози – 5-гідроксиметилфурфурол.


Бродіння
Це розпад моносахаридів під впливом ферментів мікроорганізмів, що призводить до утворення різних продуктів. Залежно від кінцевого продукту розрізняють:
а) спиртове бродіння

б) молочнокисле

АКТУАЛЬНІСТЬ ТЕМИ
Складні вуглеводи є найважливішими біологічно активними сполуками. Вони класифікуються на олігосахариди та полісахариди (гомо-і гетерополісахариди). Біологічна активність складних вуглеводів сприяє використанню у фармацевтичній практиці. Наприклад, дисахарид лактоза використовується як наповнювач при виготовленні порошків і таблеток, у виробництві молочних продуктів, харчування для немовлят, з лактози отримують лактулозу - цінний препарат для лікування кишкових розладів. Сахарозу використовують для виготовлення сиропів, мікстур. Гомополісахариди крохмаль, який є основним джерелом вуглеводів у харчовому раціоні людини, у фармації використовується для виготовлення присипок та паст. Велике значення мають гетерополісахариди, які забезпечують міцність та пружність органів. Хондроїтинсульфати, що входять до складу шкіри, хрящів, гіалуронова кислота - склоподібного тіла ока. Вони є основою багатьох лікарських препаратів (хондропротекторів, антикоагулянтів та ін.). Інтерпретацію будови та хімічних властивостей важливо при контролі якості вуглеводів, які використовуються як лікарські засоби.
ЦІЛІ НАВЧАННЯ
Загальна мета: Вміти інтерпретувати будову та хімічні властивості складних вуглеводів для подальшого вивчення їх біологічних та фармацевтичних функцій.
Конкретні цілі.
Вміти:
1. Класифікувати за будовою ді- та полісахаридів.
2. Складати назви дисахаридів.
3. Складати рівняння реакцій, що підтверджують хімічні властивості складних вуглеводів.
4. Інтерпретувати реакції ідентифікації.
1. Основні теоретичні питання:
2. Будова, класифікація та структурне зображення відновлювальних (мальтозу, целобіозу, лактозу) та непоправних (цукрозу) дисахаридів.
3. Загальні та специфічні хімічні властивості дисахаридів. Гідроліз дисахаридів. Інверсія цукрози.
4. Будова та класифікація полісахаридів.
5. Гомополісахариди крохмаль (амілоза, амілопектин), глікоген, целюлоза, декстрини. Гідроліз полісахаридів.
6. Похідні целюлози (нітрати, ацетати, ксантогенати, карбоксиметилцелюлоза) та їх не застосування у фармації. Концепція пектинові речовини.
7. Гетерополісахариди: хондроїтинсульфати, гіалуронова кислота, гепарин.
8. Ідентифікація ді- та полісахаридів (реакція Барфед, якісна реакція на крохмаль, методи).
9. Медико-біологічне та фармацевтичне значення ді- та полісахаридів та їх функціональних похідних.
2. Основні терміни та їх визначення
Дисахариди- вуглеводи, молекули яких складаються з двох залишків моносахаридів однакової або різної природи та сполучених між собою глікозидним зв'язком. Внаслідок кислотного чи ферментативного гідролізу дисахариди розщеплюються на дві молекули моносахаридів.
Дисахариди діляться на дві групи. відновлювальні та невідновлювані Залежно від способу поєднання двох залишків моносахаридів між собою.
Відновлювальні дисахариди утворюються в результаті відщеплення води з двох моносахаридів за рахунок напівацетального гідроксиду однієї молекули моносахариду і спиртового інший, наприклад мальтози, целлобіозу, лактози . Відновлювальні дисахариди мають один вільний глікозидний гідроксил, здатний до таутомерних перетворень. Для них характерні типові реакції на карбонільну групу: утворення фенілгідразонів та озазонів, приєднання водню та синильної кислоти, відновлення гідроксиду міді та фелінгової рідини, реакція срібного дзеркала та ін.
Представниками відновлювальних дисахаридів є:
Мальтоза(солодовий цукор) складається з двох залишків D глюкопіраноз, з'єднаних 1,4-глікозидним зв'язком. Утворення молекули мальтози можна як процес конденсації двох молекул глюкози:
У розчині мальтозу існує в декількох таутомерних формах - - та β-циклічної та альдегідної.

Відновлювальні властивості мальтози виявляються при окисленні Br2/H2O (при цьому утворюється мальтобіонова кислота), реактивами Толленса та Феллінга
Целобіоза, як і мальтоза , складається з двох залишків D глюкопіраноз, з'єднаних 1,4-глікозидним зв'язком, але у молекулі целобіозу напівацетальний гідроксил, який бере участь в утворенні глікозидного зв'язку має β-конфігурацію.

Целобіоза
Лактоза (молочний цукор)складається з залишку β-D-галактопіранози та - або β-D-глюкопіраноз, з'єднаних 1,4-глікозидним зв'язком.

Дисахариди, які не мають вільної глікозидної групи, а отже і не виявляють окисно-відновних властивостей непоправних . Невідновлювані дисахариди утворюються з двох молекул моносахаридів з відщепленням молекули води за рахунок напивацетальних гідроксилів обох моносахаридів, наприклад мікози, сахарози та ін. У дисахаридах цього типу немає вільних напівацетального гідроксилу. Вони не здатні до таутомерних перетворень, не дають характерних реакцій на карбонільну групу і не мають відновлювальних властивостей. Ці дисахариди здатні тільки до реакцій у гідроксильних груп - утворення ефірів та ефірів (алкілювання та ацилювання) та сахаратив.
До непоправних полісахаридів належить цукроза (тростинний або буряковий цукор), молекула якого складається з залишків -D-глюкопіраноз та β-D-фруктофуранози, з'єднаних 1,2 глікозидним зв'язком.

Сахароза
Полісахариди- це природні полімери, які складаються з великої кількості молекул моносахаридів . До полісахаридів відносяться багато продуктів рослинного походження (крохмаль, целюлоза, пектинові речовини), тварини (глікоген, хітин) та бактеріальної (декстрани). Усі вони відіграють важливу біологічну роль та використовуються як лікарські препарати. Полісахариди діляться на Гомополісахариди (побудовані тільки з ланок моносахаридів одного типу) та гетерополісахариди (побудовані з ланок моносахаридів різних типів)
Крохмаль.У рослинному світі формою запасу поживних речовин є крохмаль. Це гомополімер, утворений -D-глюкопіраноз. Крохмаль складається з двох фракцій - амілози та амілопектину. Амілопектін - полімер розгалуженої структури, може мати 1000 і більше залишків D-глюкози в молекулі. Амілоза має лінійну будову, в ній залишки -глюкози з'єднані α 1,4 зв'язками, тобто кожен залишок глюкози бере участь в утворенні двох зв'язків, за рахунок ОН-груп при С1 та С4:

При нагріванні з кислотами або за впливу ферментів крохмаль гідролізується. Кінцевим продуктом цього процесу є глюкоза:

Глікоген(Тваринний крохмаль). Якщо більшість рослин резервним полісахаридом є крохмаль, то тваринних організмах цю функцію виконує глікоген. Цей полісахарид забезпечує організм глюкозою при підвищених фізичних навантаженнях та в перервах між їдою. Глікоген побудований аналогічно амілопектину, але є ще більш розгалуженою структурою.
Молекула гомо полімеру целюлози має лінійну будову, в ній залишки β-глюкози з'єднані β-1,4-зв'язками:

При нагріванні целюлози в кислому середовищі вона гідролізується до глюкози. Це один із промислових способів добування глюкози:

Для організму мають значення такі гетерополісахариди: гіалуронова кислота - основна частина міжклітинної речовини, біологічний цемент, що сполучає клітини, заповнюючи весь міжклітинний простір. Вона також виконує роль біологічного фільтра, який затримує мікроби та запобігає їх проникненню в клітини, бере участь в обміні води в організмі. Гіалуронова кислота складається з D-глюкуронової кислоти та N-ацетил-D-глюкозаміну.
Хондроїтинсульфати- хондроїтинсерні кислоти служать структурним компонентом хрящів, зв'язок, клапанів серця, пупкового канатика. Вони сприяють відкладенню Са у кістках. Хондроїтинсульфати складаються з D-глюкуронової кислоти та N-ацетил-D-галактозаміну, що має сульфатну групу.
Гепарин- утворюється в клітинах паренхіматозних органів (печінка, легені, нирки) та виділяється ними в кров та міжклітинну рідину. У крові він зв'язується з білками та запобігає процесу згортання крові, виконуючи функцію антикоагулянту. Крім того, гепарин має протизапальну дію, впливає на обмін калію та натрію, виконує антигіпоксичну функцію. Основною ланкою цього гетерополімеру є уронова кислота D-глюкозамін, з'єднані між собою -1,4-глікозидними зв'язками.
3. Граф логічної структури
4. Джерела інформації:
1. Органічна хімія. Підручник для найвищих фармацевтичних навчальних закладів. У 3 кн. / В.П. Чорних, Б.С. Зіменковський, І.С. Гриценко. – Харків: Основа, 1997. – Кн. 3, – с.151-164.
2. Загальний практикум з органічної хімії/В.П. Чорних та ін. - Харків: Вид-во НФАУ; Золоті сторінки, 2002. – с.387-393.
3. Збірник тестів з органічної хімії/За ред. В.П.Чорних. – Харків 2005.С. 304-322.
4. Лекції з органічної хімії.
НАВЧАЛЬНІ ЗАВДАННЯ
Завдання 1
Дайте визначення термінам: відновлювальний дисахарид; непоправний дисахарид; гетерополісахарид; Гомополісахариди. Наведіть приклади.
Завдання 2
Напишіть структурні формули таких сполук: -целобіозу; метил--лактозид; мальтобіонова кислота.
Завдання 3
Складіть назви таких дисахаридів:
а)  б)
б) 
в)  с)
с) 
Завдання 4
Складіть рівняння реакцій, що підтверджують хімічні властивості лактози с1) 6 Н 5 NHNH 2 (ха.); 2) CH 3 J (ізб.); 3) HCN; 4) [H]; 5) OH; 6) C 2 H 5 OH (HCl(г)); 7) H 2 NOH; 9) (CH 3 CO) 2 O (поз).
Завдання 5
Покажіть цикло-оксо таутомерію мальтози, за допомогою яких реакцій можна підтвердити цей процес.
Завдання 6
За допомогою яких реакцій можна відрізнити цукрозу від лактози? Наведіть необхідні рівняння реакцій.
1. Який моносахарид є кінцевим продуктом гідролізу крохмалю:




А.Галактоза Ст. Фруктоза З. Маноза


D.Рибоза Є. Глюкоза
2. Залежно від способу утворення глікозидного зв'язку, дисахариди поділяються на дві групи – відновлювальні та невідновлювані. З перерахованих дисахаридів є непоправних:
A. Мальтоза
B. Целобіоза
C. Лактоза
D. Сахароза
E. Ксилоза
3. Глікоген у тваринних організмах є структурним та функціональним аналогом рослинного крохмалю. Вкажіть продукти, що утворюються при гідролізі глікогену:
A.α, D - глюкопіраноза
B.β, D - глюкопіраноза
C.α, D – галактопіраноза
D.β, D - галактопіраноза
E.α, D - фруктофуранозу
4. У відновлювальних дисахаридах спостерігається явище мутаротації. В результаті лактоза зберігає цю здатність:
A. До її складу входять спиртові гідроксиди
B. Утворює глікозидний зв'язок.
C. До її складу входить β, D-галактопіраноза
D. Містить вільну напивацетальну групу
E. До її складу входить D – глюкопіраноза
5. Мальтоза утворюється при ферментативному гідролізі крохмалю. Вкажіть за допомогою якого реагенту можна підтвердити відновлювальні здібності цього дисахариду:
A.Аg(NH 3) 2 OH
B.СН 3 -ВІН
C.СН 3 -СН 2 -ВІН
D.СН 3 СООН
E.Н 3 РВ 4
6. Важливе практичного значення мають похідні целюлози. Назвіть продукт повного нітрування целюлози:
A. Дінітрат
C. Тринітрат
D. Тетранітрат
E. Пентанітрат
7. Гіалуронова кислота-основна частина міжклітинної речовини. Вкажіть складові цієї кислоти:
A.α, D–галактуронова кислота
B.Глюкозо-1-фосфат
C. N-ацетил-D-глюкозамін
D. L-ідуронова кислота
E.β, D –фруктофуранозу
8. Молекули дисахаридів складаються із залишків моносахаридів, з'єднаних між собою глікозидним зв'язком. Вкажіть тип цього зв'язку в молекулі цукрози:
A.α -1,4
B.β-1,4
C.β-1,3
D.α-1, β-2
E.α-1,6
9. Полісахарид, виконує функцію резервної речовини в організмі людини. Цей полісахарид забезпечує організм глюкозою при підвищених навантаженнях та в проміжках між їдою. Про речовину йдеться?
A. крохмаль
B. глікоген
D. целюлоза
Еталони відповідей:
1.E, 2.D, 3.A, 4.D, 5.A, 6.E, 7.C, 8.D, 9.В.
Заняття №31
ЛИПІДИ, що омилюються
АКТУАЛЬНІСТЬ ТЕМИ
Омилюваний ліпіди - численна група природних органічних сполук, в основному похідних вищих аліфатичних кислот і спиртів. Вони містяться у всіх клітинах живих організмів та беруть участь у різних фізіологічних та біохімічних процесах. Ліпіди є основними структурними компонентами клітинних мембран, виконують захисну функцію (наприклад, у шкірі), служать формою як запасається і транспортується енергетичне " паливо " .
Обмилювані ліпіди – численна група природних органічних сполук. Прості ліпіди (жири, віск, твини) похідні вищих аліфатичних кислот та спиртів. Складні ліпіди утворюють при гідролізі крім спиртів і карбонових кислот, а також фосфорну кислоту (фосфоліпіди) або олігосахариди (гліколіпіди).
За своєю будовою жири є складними ефірами гліцерину та вищих карбонових кислот. Жири тваринного походження, як правило, – тверді речовини, рослинні жири – рідкі. До складу жирів людського організму найчастіше входять залишки насичених (стеаринова, пальмітинова) та ненасичених (арахідонова, олеїнова, лінолева та ліноленова) вищих жирних кислот.
Віск, складні ефіри вищих жирних кислот та високомолекулярних речовин, бувають рослинного, тваринного та мінерального походження. Озокерит (гірський віск) - мінеральний продукт застосовується у медицині виготовлення масел, кремів, гидроффобизации матеріалів. Ланолін і спермацет використовують у виробництві кремів, мила, свічок.
Гліцерофосфоліпіди є основним компонентом клітинних мембран. Подібно до вищих карбонових кислот вони довгий неполярний вуглеводневий ланцюг ("хвіст") і полярну іонну фосфатидну групу ("голова") і утворюють ліпідний бислой. Бісло фосфоліпідів є ефективним бар'єром для пропускання води, іонів та інших компонентів усередину та з клітин.
Розуміння особливостей будови ліпідів, уміння інтерпретувати їх хімічні властивості потрібні провізору для розуміння фармакокінетики, фармакодинаміки та механізму розподілу лікарських речовин в організмі людини.
ЦІЛІ НАВЧАННЯ
Загальна мета: Вміти інтерпретувати будову та хімічні властивості омилюваних ліпідів для подальшого вивчення їх медико-біологічних та фармацевтичних функцій.
Конкретні цілі.
1. Відносити ліпіди за будовою до певного класу відповідно до їх класифікації. Складати назви омилюваних ліпідів.
2. Пояснювати значення йодного, кислотного та ефірного чисел.
3. Складати рівняння реакцій, що підтверджують хімічні властивості простих ліпідів – триацилгліцеринів.
1. Класифікація ліпідів.
2. Будова омилюваного ліпідів.
3. Хімічні властивості триацилгліцеринів: гідроліз, гідрогенізація, окиснення, приєднання галогенів.
4. Медико-біологічне та фармацевтичне значення ліпідів.
2. Основні терміни та їх визначення:
Ліпіди- це численна група природних органічних речовин, переважно похідних вищих аліфатичних кислот і спиртів.
Різне відношення жироподібних речовин до дії гідролітичних реагентів покладено в основу поділу ліпідів на омилюваного та неомилюваного.

Жириабо омилюваного ліпіди є ефірами гліцерину та вищих аліфатичних кислот, тобто. триацилгліцеринів або тригліцеридів. Загальна формула жирів:

за консистенції жири можуть бути твердими та рідкими. Тверді жири містять переважно залишки насичених вищих жирних кислот. До складу рідких жирів, які називають оліями чи оліями, входять в основному залишки ненасичених кислот. Жири тваринного походження зазвичай – тверді речовини, рослинні жири – рідкі.
Внаслідок взаємодії жирів з водними розчинами гідроксидів лужних металів (NaОН, КОН) утворюється суміш гліцерину та натрієвих (калієвих) солей вищих жирних кислот. Зазначені солі називають милом, а реакцію лужного гідролізу жирів, якою утворюються мила, - омиленням.
Число омилення- це кількість міліграм КОН, що витрачається при гідролізі 1 г жиру. Кислотне число (число нейтралізації) визначається кількістю міліграм КОН, необхідного для нейтралізації 1 г жиру. Ефірне число - це різниця між числом омилення та кислотним числом.
Міцели- це сферичні структури, що утворюються в результаті агрегації («злипання» один з одним) молекул мила – натрієвих та калієвих солей жирних кислот. Завдяки наявності молекул карбоксилатних груп мила відносять до аніонних поверхнево-активних речовин (аніонні ПАР). При цьому вони зменшують поверхневе натяг води, тобто виявляють так звані поверхнево-активні властивості.
Гідрогенізація жирів- це реакція приєднання водню за місцем розриву карбон-карбонових подвійних зв'язків у залишках лінолевої, ліноленової, олеїнової та інших ненасичених кислот, при цьому рослинні олії перетворюються на тверді жири, які називають Саломас.
Віски- це складні ефіри вищих жирних кислот та високомолекулярних спиртів, які містять парну кількість атомів вуглецю в кислотних та спиртових залишках. Воски ділять на тварини (спермацет, бджолиний віск, ланолін та інші) та рослинні (карнаубський віск). У восків прийнято відносити також і озокерит (гірський віск) - мінеральний продукт, який є сумішшю переважно насичених вуглеводнів, в основному з розгалуженими ланцюгами.
СПОСОБИ ОТРИМАННЯ
Синтетичні способи добування жирів з гліцерину не мають промислового значення через доступність різноманітної природної сировини. До основних методів виділення жирів та олій з подрібнених тканин рослин та тварин відносяться: витоплювання, пресування та екстракція органічними розчинниками.
ХІМІЧНІ ВЛАСТИВОСТІ
1. Гідроліз жирів.


2. Реакції приєднання. Ліпіди з залишками ненасичених кислот легко приєднують по подвійному зв'язку водень, галоген, галогенводні та воду.

3. Окислення жирів. Причиною здатності жирів легко окислюватися киснем повітря є наявність подвійних зв'язків у їхніх молекулах, що призводить до «гіркнення» жирів. При їх окисленні утворюються альдегіди з короткими карбоновими ланцюгами, які зумовлюють неприємний запах і смак жирних жирів.
Граф логічної структури
| Віски |
| Жири |
4. Джерела інформації
1. Органічна хімія. Підручник для найвищих фармацевтичних навчальних закладів. У 3 кн. / В.П. Чорних, Б.С., Зименковський І.С., Гриценко. – Харків: Основа, 1997. – Кн. 3, – с.196-234.
2. Загальний практикум з органічної хімії/В.П. Чорних та ін. - Харків: Вид-во НФАУ; Золоті сторінки, 2002. – с.592 с.
3. Лекції з органічної хімії.
4. Лекції з органічної хімії. - М: Вища школа, 1991. - с.76-86.
НАВЧАЛЬНІ ЗАВДАННЯ
Завдання 1
Назвіть такі з'єднання:



Завдання 2
Напишіть структурні формули: а) тристеарин; б) олепальмітостеарин.
Завдання 3
Напишіть схеми кислотного та лужного гідролізу пальмітодистеарину. Назвіть продукти реакції.
Завдання 4
Напишіть рівняння реакцій тріолеїну з наступними реагентами: 1) Br2; 2) HJ(kt). Що таке йодне число, кислотне число та число омилення
ЗАДАЧІ ДЛЯ ПЕРЕВІРКИ ДОСЯГНЕННЯ КОНКРЕТНИХ ЦІЛІВ НАВЧАННЯ
1. Складні ліпіди за своєю будовою складаються із трьох і більше компонентів. Серед наведених сполук вкажіть такий ліпід:
B. Стеаринова кислота
C. Тригліцерид
E. Гліколіпід
2. Поліненасичені жирні кислоти входять до складу ліпідів. Серед таких сполук вкажіть таку кислоту:
A. СН 2 = СН-СООН
B. З 17 Н 35 СООН
C. СН 3 СООН
D. З 17 Н 29 СООН
E. СН 2 =СН-СН=СН-СООН
3. Рідкий жир - тріолеїн гліцерину - можна отримати синтезом з гліцерину та вищої жирної кислоти. Визначте тип хімічної реакції, яка використовується для отримання жиру:
A. Гідрогенізація
B. Гідроліз
C. Етерифікація
D. Дегідратація
E. Окислення
4. Лляна олія містить приблизно 60% лінолевої кислоти. Серед наведених сполук вкажіть формулу цієї кислоти:
A.З 15 Н 31 – СООН
B.З 17 Н 39 - СООН
C.З 17 Н 29 - СООН
D.З 17 Н 31 – СООН
E.З 17 Н 33 - СООН
5. Фосфоліпіди відносяться до складних омилюваних ліпідів. Вкажіть хімічну природу цих сполук:
A. Складні ефіри гліцерину та ненасичених ВЖЕ
B. Складні ефіри гліцерину та насичених СЖК
C. Складні ефіри гліцерину та Н3РО4.
D. Складні ефіри сорбіту та СЖК
E. Складні ефіри гліцерину, СЖК та Н3РО4.
6. Визначають якість жиру. Ненасиченість жиру характеризує:
A. йодне число
B. число омилення
C. ефірне число
D. кислотне число
7. Для проведення екстракції визначають розчинність ліпідів у різних розчинниках. Ліпіди будуть погано розчинні в:
A. хлороформі
B. толуолі
C. циклогексани
D. бензоле
E. етиловий спирт
8. За своєю хімічною будовою жир відноситься до класу:
A. Простий ефір.
B. багатоатомний спирт.
C. Складний ефір.
D. Сіль найвищих карбонових кислот.
E. Карбонова кислота.
9. Вищі жирні кислоти входять до складу ліпідів. Серед наведених нижче сполук виберіть кислоту, яка входить до складу тваринного жиру:
A. CH 3 - (CH 2) 3 - COOH
B. CH 3 - CO - CH 2 - COOH
C. C 17 H 33 - COOH
D. C 17 H 35 - COOH
E. C 17 H 29 - COOH
10. Визначити якісний склад твердого тваринного жиру. Знайдіть кислоту, яка входить до складу такого жиру:
A.Олеїнова.
B.Стеаринова.
C.Лінолева.
D.Ліноленова.
E.Малеїнова.
Еталони відповідей:
1.E, 2.D, 3.A, 4.C, 5.E, 6.A, 7.E, 8.C, 9.D, 10.B.
Заняття №32
Неомилювані ЛІПІДИ
АКТУАЛЬНІСТЬ ТЕМИ
У неомилювані ліпіди відносять не здатні до гідролізу ізопреноїди та простагландини. Простагландини в надзвичайно малих концентраціях містяться у всіх клітинах організму та тварин, проте найбільша їх кількість знаходиться у спермі. Вчені припускають, що простагландини регулюють обмін речовин у клітинах організму, тобто "клітинними гормонами". Вони впливають на процеси згортання крові, знижують кров'яний тиск, пригнічують виділення шлункового соку і т. д. Найважливішою властивістю простагландинів є їхня здатність стимулювати скорочення гладкої мускулатури.
Ізопреноїди - це велика та різноманітна за своєю будовою та властивостями група речовин, похідних ізопрену. До них відносять терпени, каротиноїди та стероїди. У природі терпені зустрічаються у складі ефірних олій. На відміну від жирних олій, ефірні олії є леткими і повністю випаровуються, не залишаючи жирних олій. Ефірні олії – джерела запахів різних рослин. У медицині застосування ефірних олій особливо виділяється ароматерапії.
У каротиноїдів, подібних до будови з природним пігментом каротином, відноситься вітамін А1. Вітамін А1 вважається фактором зростання. При нестачі його в їжі спостерігається затримка росту, схуднення, висихання рогівки ока, знижується імунітет.
До стероїдів відносяться речовини тваринного та рослинного походження, на основі яких знаходиться система стерану. У ряді стероїдів розрізняють: стерини, жовчні кислоти, стероїдні гомони, аглікони серцевих глікозидів, аглікони стероїдних сапонінів.
Вивчення цих властивостей дає можливість пізнати ті хімічні перетворення, які відбуваються з ліпідами при застосуванні їх як лікарських засобів, спрогнозувати зміни, що відбуваються при зберіганні ліків, зрозуміти взаємозв'язок між їхньою хімічною будовою та дією на організм, досліджувати нові методи синтезу лікарських речовин.
ЦІЛІ НАВЧАННЯ
Загальна мета: Вміти інтерпретувати будову та хімічні властивості неомилюваних ліпідів для подальшого вивчення їх медико-біологічних та фармацевтичних функцій.
Конкретні цілі.
1. Визначати ліпіди відповідно до їх класифікації.
2. Інтерпретувати будову окремих представників неомилюваних ліпідів.
3. Складати рівняння реакцій, характерних для неомилюваних ліпідів.
1. Основні теоретичні питання:
1. Класифікація ліпідів.
2. Будова неомильних ліпідів - простагландинів.
3. ізопреноїдів. Будова та хімічні властивості терпенів - камфори, ментолу, ментани, α-пінена, борнеолу.
4. Будова каротиноїдів (вітамін А1) та стероїдів. Холестерин, жовчні кислоти, стероїдні гормони, андрогени та аглікони серцевих глікозидів.
5. Медико-біологічне та фармацевтичне значення ліпідів.
2. Основні терміни та їх визначення:
В неомилювані ліпідів відносяться не здатні до гідролізу ізопреноїди та простагландини.
Простагландини- це фізіологічно активні речовини біогенного походження, що стимулюють мускулатуру та знижують кров'яний тиск. Простагландини містять карбоксильну групу і 20 атомів вуглецю в молекулі, тобто їх можна розглядати як похідні ейкозанової кислоти.

Ізопреноїди- це група природних сполук, які мають у своєму складі ізопреновий фрагмент СН2 = С (СН 3) СН = СН2. Структуру ізопреноїдів мають деякі лікарські засоби, вітаміни, гормони, ароматичні речовини тощо. До ізопреноїдів відносять терпеливі, каротиноїди.
Терпени.Група терпенов включає терпенові вуглеводні та його оксигеновмисни похідні (спирти, альдегіди, кетони), звані терпеноиды (ментол, камфора). У терпенових вуглеводнів належать ненасичені вуглеводні складу (С5Н8) n, де n вказує кількість ізопренових фрагментів і коливається від 2 до 8. У природі терпени зустрічаються у складі ефірних олій.
Каротиноїди- група природних пігментів, які мають у своєму складі значну кількість пов'язаних подвійних зв'язків, чим, власне, і пояснюється їх забарвлення. Більшість каротиноїдів відносяться до тетратерпени, тому що їх молекули містять 40 атомів вуглецю.
Усі ізомери каротину є попередниками вітамінів групи А, тобто провітамінами. Під впливом ферментів в організмі вони розщеплюються за місцем зв'язку З-З утворенням вітаміну А - ретинолу.

Вітамін А (ретинол)міститься лише у продуктах тваринного походження. Багатими його джерелами є вершкове масло, яєчний жовток, печінка тварин та морських риб, риб'ячий жир.

Стероїди- це ліпіди тваринних організмів. В основі їх структури лежить конденсований чотирициклічний кістяк, що називають стераном. До стероїдів відносять різні речовини гормональної природи, наприклад холестерин.

Порушення обміну холестерину в організмі людини призводить до його відкладення на стінках артерій та зменшення еластичності судин (атеросклерозу). Холестерин в організмі перетворюється на інші стероїди, наприклад, в жовчні кислоти , які виконують важливу функцію під час перетравлення їжі. Холестерин є попередником всіх стероїдних гормонів. Гормони - це біологічно активні речовини, що утворюються в результаті діяльності залоз внутрішньої секреції та беруть участь у регуляції обміну речовин та фізіологічних функціях організму. Статеві гормони - це речовини, що виробляються статевими органами та регулюють статеві функції. До них належать жіночі (гестагени та естрогени) та чоловічі гормони (андрогени).
Подібна інформація.
Державна бюджетна освітня установа
вищої професійної освіти
МОСКІВСЬКИЙ ДЕРЖАВНИЙ МЕДИКО-СТОМАТОЛОГІЧНИЙ УНІВЕРСИТЕТ
імені О.М. ЄВДОКИМОВА
КАФЕДРА ЗАГАЛЬНОЇ ТА БІООРГАНІЧНОЇ ХІМІЇ
Вуглеводи
ОЛІГО - , ПОЛІСАХАРИДИ
лекція №24
Олігосахариди.
Олігосахариди складають проміжну групу між моно- та полісахаридами. Як правило, до них відносять вуглеводи, що містять у своїй молекулі від двох до десяти залишків моносахаридів.
Найпростішими олігосахаридами є дисахариди. За своїми фізико-хімічними властивостями вони багато в чому подібні з моносахаридами: мають здатність кристалізуватися, розчиняються у воді і мають солодкий смак. Відмінність полягає у здатності дисахаридів до кислотного гідролізу.
Утворення дисахаридів відбувається шляхом димеризації моносахаридів з обов'язковою участю хоча б однієї глікозидної OH-групи. Існує два типи зв'язування моносахаридних залишків: «голова до хвоста» та «голова до голови». Під терміном "голова" мають на увазі глікозидну OH-групу, під терміном "хвіст" - будь-яку іншу гідроксильну групу. У першому випадку утворюються дисахариди, звані відновлювальними, у другому невосстанавливающими.
Схему перебігу димеризації за принципом «голова до хвоста» можна так:
Зв'язок, що утворюється, називають глікозидним і позначають
- (або -) (1 4), де цифри показують положення гідроксилів, що утворюють зв'язок, а - (або -) конфігурацію цього зв'язку.
Принцип «голова до голови» реалізується так:

Відновлюючі дисахариди.
Серед відновлювальних дисахаридів поширені мальтоза, лактоза, і целобіозу. Ці дисахариди ізомерні один до одного і відповідають загальній формулі C 12 H 22 O 11 .
Мальтоза (солодовий цукор) складається з двох залишків D-глюкопі-ранози, пов'язаних (1 4)-глікозидним зв'язком:

Аномерний атом вуглецю, що бере участь у освіті глікозидного зв'язку, має α-конфігурацію. Другий аномерний атом може мати як α-(α-мальтоза), так і -конфігурацію (-мальтоза). Переважаючою є -форма.
Перша молекула глюкози, що поставляє для утворення зв'язку глікозидну OH-групу, розглядається як заступник у 4-му положенні другого моносахариду. У зв'язку з цим у назві дисахарида вона набуває суфікс-озил, у назві ж другої молекули зберігається суфікс-озу. У назві дисахарида обов'язково вказується конфігурація обох аномерних атомів. Таким чином, повна номенклатурна назва α-мальтози: α-D-глюкопіранозил-
(1 4)-α-D-глюкопіраноза.
Мальтоза – проміжний продукт розщеплення крохмалю та глікогену у шлунково-кишковому тракті. У вільному вигляді в харчових продуктах вона зустрічається в меді, солоді, пиві, патоці та пророслому зерні. Одержують мальтозу гідролізом крохмалю.
Лактоза складається з залишку -D-галактопіранози (невідновлювальна ланка), пов'язаного -(1 4)-глікозидним зв'язком із залишком
D-глюкози:

Аномерний атом глюкозного фрагмента може мати як α-(α-лактоза), так і -конфігурацію (-лактоза). Повна назва лактози: -D-галактопіранозил-(1 4)-α-(або )-D-глюкопіраноза.
У природі лактоза міститься лише у молоці. Вона погано розчинна у холодній воді та у шлунково-кишковому тракті розщеплюється до глюкози та галактози під дією ферменту лактази. Дефіцит цього ферменту в деяких людей призводить до непереносимості молока. Нерозщеплена лактоза є хорошою поживною речовиною для кишкової мікрофлори. У кисло-молочних продуктах більшу частину лактози зброджують до молочної кислоти, тому люди з лактазною недостатністю можуть переносити кисломолочні продукти без неприємних наслідків. Крім того, молочнокислі бактерії в кисломолочних продуктах пригнічують діяльність кишкової мікрофлори та знижують несприятливі дії лактози.
Целлобіоза утворена двома D-глюкопіранозними залишками, але на відміну від мальтози, (1 4)-глікозидний зв'язок має β-конфігурацію:

Целлобіоз є структурним компонентом целюлози. Цікаво, що фермент -глюкозидаза (мальтаза), що розщеплює мальтозу, неактивний по відношенню до целлобиозе. Це різницею у зміни глікозидного зв'язку. Целлобіоз розщеплюється за допомогою -глюкозидази, яка в організмі людини відсутня. Тому целлобиоза та її полімер целюлоза в організмі людини не переробляються і не можуть бути джерелом харчування. У той же час жуйні тварини вживають в їжу рослини, що містять целюлозу, тому що в їхньому травному тракті є бактерії, що містять -глюкозидазу.
Відновлюючі властивості мальтози, лактози та целобіози обумовлені наявністю вільної напівацетальної гідроксильної групи, внаслідок чого зберігається здатність до розкриття циклу та утворення аномерів:

Таким чином, розчини відновлювальних дисахаридів мутаротують, але оскільки синтез природних дисахаридів за участю ферментів строго стереоспецифічний, глікозидний зв'язок може перебувати лише в одній із можливих конфігурацій
(α- або β-) та на її стереохімію мутаротація не впливає. Крім того, дисахариди, що відновлюють, вступають у реакції з реактивами Бенедикта, Феллінга і Толленса.
Невідновлювальні дисахариди.
Прикладом найбільш поширених у природі невідновлюваних дисахаридів є цукроза(буряковий або тростинний цукор). Молекула сахарози складається з залишків α-D-глюко-піранози та β-D-фруктофуранози, з'єднаних один з одним за рахунок взаємодії обох напівацетальних гідроксилів, тобто (1 2)-глі-козидним зв'язком:

У назву невідновлювальних дисахаридів один із моносахаридних залишків входить у загальну назву з суфіксом
-озил, а інший із суфіксом -озид. Якщо дисахарид складається з залишків двох однакових моносахаридів, то не має значення, який буде названий першим. Якщо ж до складу дисахариду входять залишки різних моносахаридів, то назва будується відповідно до номенклатурного принципу: фрагменти моносахаридів розташовують в алфавітному порядку. Таким чином, назва цукрози: α-D-глюкопіранозіл-(1 2)-β-D-фруктофуранозід.
Відсутність напівацетального гідроксилу в молекулі сахарози призводить до того, що сахароза не має таутомерної оксо-форми і тому не має відновлюючих властивостей, а її розчини не мутаротують.
Хімічні властивості дисахаридів.
Для відновлювальних дисахаридів характерні багато реакцій, в які вступають моносахариди: утворення глікозидів, простих та складних ефірів, окислення та ін. Деякі процеси наведені на схемі 2:

Схема 2. Хімічні перетворення мальтози.
Однак на відміну від моносахаридів дисахариди здатні до кислотного гідролізу, в результаті якого розривається глікозидний зв'язок та утворюються моносахариди. Так, при гідролізі сахарози утворюється суміш глюкози та фруктози:

Отримана суміш моносахаридів має ліве обертання (39,5 °), в той час як вихідна речовина - сахароза - характеризується протилежним кутом обертання (66,5 °). Така зміна знака пов'язана з тим, що при гідролізі утворюється фруктоза, що має кут обертання, рівний -92 °, глюкоза, що обертається вправо на +52,5 °. Різниця між цими величинами і буде кутом обертання суміші глюкози та фруктози. Зміна кута обертання під впливом гідролізу називається інверсією(від лат. inversia перевертання), а суміш глюкози та фруктози, отриману при цьому, називають інвертним цукромабо штучним медом. Натуральний мед – природний інвертний цукор, який утворюється в організмі бджоли з цукрози під впливом ферменту інвертази.
До лужного гідролізу дисахариди стійкі.
Полісахариди.
Більшість вуглеводів зустрічається у природі у вигляді полісахаридів. Полісахариди (поліози) - це високомолекулярні сполуки, що складаються з великої кількості моносахаридних залишків, сполучених глікозидними зв'язками. Загальна формула полісахаридів (З 6 Н 10 5) n .
Макромолекули полісахаридів відрізняються один від одного природою моносахаридних ланок, що повторюються, довжиною ланцюга і ступенем розгалуження. Відносна молекулярна маса полісахаридів варіює в широких межах: від кількох тисяч до кількох мільйонів, тому що будь-який зразок полісахариду него-могенний за складом, а складається з полімергомологів різної довжини та молекулярної маси. Багато полісахаридів утворюють високоупоро-дочені надмолекулярні структури, що перешкоджають гідратації окремих молекул, тому такі полісахариди (хітин, целюлоза) не тільки не розчиняються, а й не набухають у воді.
Гомополісахариди.
До гомополісахаридів відносяться полісахариди рослинного (крохмаль, целюлоза, пектинові речовини), тварини (глікоген, хітин) та бактеріального (декстрини) походження, що складаються із залишків моносахариду одного типу. Більшість їх цим моносахаридом є D-глюкоза.
З урахуванням біологічної ролі гомополісахариди діляться на структурніі резервні. До резервних відносяться крохмаль та глікоген; до структурних целюлоза та хітин.
Резервні полісахариди.
Крохмаль це суміш двох полісахаридів (амілози та аміло-пектину), до складу яких входять залишки α-D-глюкопіранози. Утворюється в рослинах у процесі фотосинтезу і міститься в бульбах, коренях, насінні. Ланцюг амілози лінійний і включає
200-1000 глюкозних залишків. Відносна молекулярна маса становить 160000.

У водному розчині макромолекулярний ланцюг амілози згорнутий у спіраль, тому у воді амілоза не дає істинного розчину, а утворює гідратовані міцели, які при додаванні йоду забарвлюються в синій колір.
Амілопектінмає розгалужену (зіркоподібну) будову. На відміну від амілози амілопектин при набуханні у водних розчинах утворює клейстер.

Відносна молекулярна маса амілопектину в сотні більша ніж у амілози і становить 1-6 млн. У воді амілопектин також утворює колоїдні розчини, проте при додаванні йоду розчин забарвлюється не в синій, а в червоно-фіолетовий колір.
Гідроліз крохмалю при нагріванні у присутності мінеральних кислот призводить до утворення різних продуктів:
де m n.
Розчинний крохмаль це частково гідролізований поліса-харид. Його молекулярна маса дещо менша, ніж звичайного крохмалю. Розчинний крохмаль розчиняється у гарячій воді, з йодом дає синє фарбування.
Декстрини це полісахариди із проміжною довжиною ланцюга. Вони є продуктами неповного гідролізу крохмалю. Вони добре розчиняються у холодній воді і з йодом забарвлюються від фіолетового до жовтого кольору. Промисловий спосіб отримання декстринів - нагрівання крохмалю до 180-200 0 С. Наприклад, процес хлібопечення полягає в перетворенні нерозчинного крохмалю в декстрини, що розчиняються і набагато легше засвоюються організмом.
Блискуча поверхня накрохмаленої білизни після прасування гарячою праскою також пояснюється утворенням декстринів.
Крохмаль – цінний харчовий продукт. Застосовується і у хімічної промисловості. Наприклад, кислотний гідроліз крохмалю (при кип'ятінні) є промисловим методом отримання глюкози. Крохмаль є сировиною для виробництва етилового та н-бутилового спиртів, ацетону, молочної та лимонної кислот, гліцерину та інших продуктів. Він використовується для приклеювання паперу та картону, виробництва декстринів та клеїв.
У травному тракті гідроліз основних компонентів крохмалю протікає під впливом ферментів. Гідроліз амілози протікає під дією ферменту α-амілази, який присутній у слині та соку підшлункової залози. Цей фермент гідролізує
α-(1 4)-глікозидні зв'язки з утворенням в кінцевому підсумку суміші глюкози та мальтози. α-(1 6)-глікозидні зв'язки, що знаходяться в точках розгалуження, гідролізуються за допомогою ферменту α-(1 6)-глюкозидази. Кінцевими продуктами гідролізу також є глюкоза та мальтоза.
У тварин організмах функціональним аналогом рослинного крохмалю є глікоген. Особливо багато його міститься у печиві у м'язах. Відносна молекулярна маса вуглеводу становить 100 млн. За структурою глікоген близький до амілопектину і відрізняється від нього більшим ступенем розгалуженості. У травному тракті глікоген легко гідролізується амілазами, що дозволяє проводити швидку регенерацію глюкози в організмі людини у разі стресових ситуацій при фізичних та розумових навантаженнях. У клітинах гідроліз глікогену здійснюється фосфоролітичним шляхом за допомогою ферменту фосфорилази, яка послідовно відщеплює молекули глюкози у вигляді
1-фосфат.
В цілому, функцію резервних полісахаридів можна представити так: якщо в клітині є надлишок глюкози, то під дією відповідних ферментів її молекули приєднуються до молекул крохмалю або глікогену; якщо ж виникає метаболічна потреба в глюкозі, то відбувається її ферментативне відщеплення від полісахаридів.
У мікроорганізмах (дрожжах, бактеріях) роль резервних полісахаридів виконують декстрани. Вони також є полісахаридами з розгалуженим ланцюгом і складаються з залишків
D-глюкози, але відрізняються від крохмалю та глікогену тим, що структурні одиниці їх остова пов'язані головним чином α-(1 6)-глікозидними зв'язками. Декстрани, що синтезуються бактеріями, що мешкають на поверхні зубів, є компонентами зубного нальоту.
Структурні полісахариди.
Целюлоза, або клітковина(від лат. cellula - клітина), - головна складова частина оболонок рослинних клітин, що виконує функції конструкційного матеріалу. Деревина складається з целюлози приблизно на 50%, а волокна бавовнику (очищена вата) є майже чистою целюлозою (до 96%).
Целюлоза являє собою полісахарид, який складається із залишків β-D-глюкопіранози, пов'язаних між собою -(1 4)-глі-козидними зв'язками:

Відносна молекулярна маса целюлози становить від 400 тисяч до 1-2 млн. Макромолекули целюлози мають лінійну будову та утворюють щільну кристалічну структуру. Цим пояснюється висока стійкість целюлози до механічних та хімічних впливів, а також вкрай низька розчинність у воді, спирті, ефірі, ацетоні та інших розчинниках.
В організмі людини та більшості ссавців целюлоза не розщеплюється ферментами шлунково-кишкового тракту, але має велике значення: виступає в ролі баласту та допомагає травленню, механічно очищаючи слизові оболонки шлунка та кишечника. Так, клітковина сприяє виведенню з організму надлишку холестерину. Пояснюється це тим, що клітковина рослинної їжі адсорбує стерини і перешкоджає їх всмоктування. Крім того, клітковина відіграє важливу роль у нормалізації корисної кишкової мікрофлори.
При тривалому нагріванні целюлози з мінеральними кислотами можна отримати проміжні продукти гідролізу , аж до D-глюкози:
де m n.
Полісахарид хітінслужить головним структурним елементом твердого зовнішнього скелета комах та ракоподібних. Він являє собою гомополімер N-ацетил-D-глюкозаміну, залишки якого пов'язані між собою -(1 4)-глікозидними зв'язками, і за структурою близький до целюлози:

Як і целюлоза, хітин нерозчинний у воді та його ланцюга мають кристалічну упаковку.
До структурних гомополісахаридів належать також інулін, побудований з залишків D-фруктози (рідкісний випадок, коли полісахарид побудований з залишків кетоз) і пектинові речовини, що складаються із залишків уронових кислот (наприклад, галактуронової) Пектинові речовини містяться в рослинних соках, плодах (яблука, груші, лимон) та овочах (буряк, морква). Сучасними дослідженнями встановлено можливість їх використання з терапевтичною метою при захворюваннях шлунково-кишкового тракту. Так, препарат "плантаглюцид", що отримується з подорожника, використовується при виразковій хворобі.
Гетерополісахариди.
Гетерополісахариди являють собою полімери, побудовані з моносахаридів різних типів та їх похідних. Найчастіше гетерополісахариди складаються з двох різних мономерів, розташованих повторюваним чином. Найважливішими представниками гетерополісахаридів в органах і тканинах тварин і людини є глікозаміноглікани (мукополісахариди ). Вони складаються з нерозгалужених ланцюгів, що містять аміносахара та уронові кислотиі виконують важливі біологічні функції. Зокрема, вони є основою вуглеводних компонентів сполучних тканин (хрящів, сухожиль та ін.), входять до складу кісток та забезпечують міцність та пружність органів.
Важливу біологічну роль відіграє гіалурова кислота: з нею пов'язані процеси запліднення, захист від проникнення мікро-організмів, вона знаходиться в склоподібному тілі ока, в порожнині суглобів і т. д. глюкозаміну, пов'язаних -(1 3)-глікозидним зв'язком. У свою чергу, дисахаридні залишки з'єднані -(1 4)-глікозидним зв'язком:

Гіалуронова кислота має високу молекулярну масу.
2-710 6 , її розчини мають високу в'язкість.
Інший мукополісахарид, виявлений у складі клітинних оболонок та основної позаклітинної речовини, це хондроїтин. За своєю структурою хондроїтин майже ідентичний гіалуронової кислоти: єдина відмінність полягає в тому, що замість залишків N-ацетил-D-глюкозаміну він містить залишки N-ацетил-D-галактозаміну.
Такий дисахарид називається N-ацетилхондрозин:

Сірчанокислі ефіри хондроїтину називаються хондроїтинсуль-фатами. Розрізняють хондроїтин-4- і хондроїтин-6-сульфати, в яких сульфатна група утворює складноефірний зв'язок з гідроксильною групою N-ацетил-D-галактозаміну відповідно при С-4 і при С-6. Вони є основними структурними компонентами хрящової та кісткової тканини, рогівки та інших видів сполучної тканини хребетних. Молекулярна маса хондроітинсульфатів коливається в діапазоні від 10 до 60 тисяч.

У тварин організмах також поширений гепарин, який був виділений з печінки, тканин серця та легень, а також з м'язів. Він є природним антикоагулянтом крові і тому відіграє важливу біологічну роль.
Гепарин має більш складну будову: ланками, що чергуються, є дисахариди, до складу яких входять залишки
D-глюкозаміну, пов'язані -(1 4)-глікозидним зв'язком із залишками або D-глюкуронової, або L-ідуронової кислоти. У свою чергу, дисахариди пов'язані між собою -(1 4)-зв'язком, якщо дисахарид закінчується D-глюкуроновою кислотою та -(1 4)-зв'язком якщо
D-ідуронової кислоти.
Більшість аміногруп гепарину сульфатовані, деякі – ацетильовані. Крім того, у ряду залишків L-ідуронових кислот су-льфатні групи містяться при С-2, а у глюкозамінних – при С-6.

Структурним елементом стінок кровоносних судин є гепаритинсульфат, який містить аналогічні дисахаридні одиниці, але має у своєму складі більше N-ацетильних груп та менше сульфатних груп.
Хімічні властивості полісахаридів.
Хімічні властивості полісахаридів в основному пов'язані з наявністю ОН-груп та глікозидних зв'язків. Частка вільних альдегідних груп у макромолекулі порівняно невелика, тому полісахариди властивостей, що відновлюють, практично не виявляють.
З хімічних властивостей полісахаридів найбільше значення мають реакції гідролізу та утворення похідних рахунок реакцій макромолекул по гидроксильным групам.
Полісахариди стійкі до гідролізу в лужному середовищі, але при дії концентрованих лужних розчинів можуть утворювати алкоголяти. Так, наприклад, одержують лужну целюлозу:

У кислому середовищі при неповному гідролізі утворюються олигосахариды, зокрема і дисахариди. Повний гідроліз полісахаридів веде до утворення моносахаридів. Здатність полісахаридів до гідролізу збільшується у ряду: целюлоза
І
H+
з целюлози (відходів деревообробної промисловості) в результаті кислотного гідролізу і подальшого зброджування глюкози, що утворюється, отримують етанол (званий «гідролізним спиртом»):
(C 6 H 10 O 5) n + nH 2 O nC 6 H 12 O 6
C 6 H 12 O 6 2C 2 H 5 OH + 2CO 2
Серед похідних полісахаридів найбільш практичне значення мають прості та складні ефіри. Така хімічна модифікація полімерів не супроводжується істотною зміною ступеня полімеризації макромолекул.
Складні ефіри целюлози утворюються при дії на целюлозу мінеральних чи органічних кислот та його ангідридів. Так, при взаємодії целюлози із сумішшю азотної та сірчаної кислот можна отримати нітрати целюлози:

Залежно від кількості гідроксильних груп у глюкозній ланці, що вступили в реакцію етерифікації, утворюються різні ефіри: моно-, ді- та тринітрат целюлози. Суміш моно- та динітрату целюлози називають колоксилін, а тринітрат целюлози – піроксилином. На основі нітратів целюлози (нітроцелюлози) одержують різні вибухові речовини, наприклад, порох. Нітрати целюлози також є основою для отримання нітролаків та емалей.
При взаємодії целюлози з оцтовою кислотою (у присутності сірчаної кислоти) або оцтовим ангідридом утворюється целюлози ацетат. Найбільше промислове значення отримав повний ефір - тріацетат целюлози - званий штучним шовком:

Ацетати целюлози застосовують також для одержання пластмас, фото- та кіноплівки, спеціальних лаків.
З простих ефірів целюлози особливе значення набули метил-, етил-і бутилцелюлоза. Вони утворюються при дії галоген-алканів на лужну целюлозу. Наприклад:

Вуглеводи поділяють на прості (моносахариди) та складні (полісахариди).
Моносахариди (монози). Це гетерополіфункціональні сполуки, що містять карбонільну та кілька гідроксильних груп. Моносахариди мають молекулярну формулу п(Н 2 Про) п, Яка і послужила основою для назви даного класу з'єднань (вуглець + вода). За своєю структурою монози відносяться до поліоксіальдегідів, або альдозів, або поліоксикетонів, або кетозів. Залежно від кількості атомів вуглецю монози ділять на тріози (три атоми вуглецю), тетрози (чотири атоми), пентози (п'ять атомів), гексизи (шість атомів) та гептози (сім атомів). Залежно від будови карбонільної групи кожну з моноз позначають: альдотріоз, альдогексоз, кетогексоз тощо.
Оптична ізомерія моносахаридів. Характерною особливістю структури моносахаридів є наявність у молекулах асиметричних (тобто мають чотири різні замісники) атомів вуглецю. Асиметричні атоми вуглецю є центрами хіральності молекули. Наслідок хіральності молекули – явище оптичної ізомерії, або енантіомерії, що виявляється у здатності з'єднання обертати площину поляризованого світла у протилежні сторони. З'єднання з асиметричними атомами вуглецю може бути у вигляді 2 ізомерів. У сполуках з однаковими асиметричними атомами вуглецю кількість оптичних ізомерів зменшується внаслідок існування мезоформ. Мезосполуки оптично неактивні через «внутрішню компенсацію» знака обертання. Прикладом мезосполуки є D-ксиліт.
Оптичні ізомери, що стосуються один одного як несиметричний предмет до свого дзеркального відображення, називають енантіомерами, або оптичними антиподами. Енантіомери відрізняються один від одного конфігурацією всіх центрів хіральності і утворюють D-форму (лат. Dexter – правий) та L-форму (лат. laevus – лівий) – стереохімічні ряди моносахаридів. Ізомери, що відрізняються конфігурацією лише частини центрів хіральності та не є оптичними антиподами, називають діастереомерами. Пару діастереомерів, що відрізняються конфігурацією лише одного асиметричного атома вуглецю, називають епімерами. Зазвичай до назви додають номер епімерного атома вуглецю, 2-епімери називають просто епімерами. Наприклад, D-аллоза та D-альтроза – епімери, D-аллоза та D-глюкоза – 3-епімери, D-аллоза та D-гулоза – 4-епімери.
Як стандарт для визначення належності з'єднання до стереохімічного D- або L-ряду прийнята конфігурація асиметричного атома в найпростішій тріозі - D-гліцериновому альдегіді. Приналежність сполуки стереохімічному ряду визначає зміна асиметричного атома вуглецю з максимальним номером (у разі глюкози - атома З 5). Якщо вона збігається зі зміною асиметричного атома вуглецю D-гліцеринового альдегіду, з'єднання відносять до D-ряду, а то й збігається - до L-ряду. Встановлено, що це природні монози ставляться до D-ряду.
Цикло-оксо-таутомерія моносахаридів. У твердому стані та у водному розчині моносахариди переважно існують у вигляді циклічних напівацеталей. Утворення напівацеталей можна розглядати як внутрішньомолекулярну реакцію A N , в результаті якої утворюються найбільш стійкі шестичленні цикли (піранозна) і п'ятичленові цикли (фуранозні). Таким чином, у розчині встановлюється таутомерна рівновага між відкритою (оксо-формою) та циклічною формою моносахариду, причому циклічна форма значно переважає (більше 99,9 % у рівноважній суміші):
Для зображення на площині просторової структури сполук у відкритій формі використовують проекційні формули Фішера, а для зображення на площині просторової структури циклічних сполук застосовують проекційні формули Хоуорса:
У цьому керуються такими правилами: цикл зображують плоским; заступники, що знаходяться в оксо-формі праворуч, зображують під площиною циклу, а ліворуч - над площиною циклу; атоми водню зв'язків СН можуть бути не показані.
У циклічній формі з'являється додатковий в порівнянні з відкритою формою асиметричний атом вуглецю (центр хіральності): атом С 1 в альдозах або атом С 2 в кетозах, званий аномерним атомом вуглецю, і додаткова група -ОН, звана напівацетал' гідроксилом (у формулі Хоуору показаний *). Якщо конфігурація аномерного атома вуглецю збігається зі зміною атома, що визначає належність сполуки стереохімічному ряду, його називають a-аномером, а то й збігається - b-аномером.
Таким чином, a- та b-аномери моноз можна розглядати як ізомери положення напівацетального гідроксилу. Перехід аномерних форм a « b здійснюється лише через відкриту оксо-форму: a-форма « оксо-форма « b-форма
Аналогічно встановлюється рівновага в розчині між піранозними та фуранозними формами. Переважання а- або b-аномера залежить від природи монози, розчинника, концентрації та інших зовнішніх умов. Рівновага між усіма формами є, таким чином, динамічним. Так, якщо який-небудь аномер глюкози розчинити у воді, він поступово перетворюється на інший аномер, доки не утворюється рівноважна суміш двох аномерів, в якій також міститься дуже невелика кількість відкритої форми. Цей перехід супроводжується зміною оптичного обертання розчину. Таке явище називають мутаротацією(аномеризацією) моносахаридів. Рівноважна суміш, що утворюється в результаті мутаротації як a-, так і b-D-глюкопіраноз, містить 36% a-ізомеру та 64% b-форми. Частка оксо-форми в рівноважній суміші невелика (при рН 6,9 рівноважна суміш D-глкжози містить лише малу частину альдегідної форми). Тому монози не дають характерного для альдегідів фарбування реакції з фуксиносернистой кислотою і не реагують з гідросульфітом натрію. Мутаротація каталізується кислотами та основами. У твердому стані монози знаходяться виключно у циклічній формі.
Хімічні властивості моносахаридів.У хімічному відношенні монози поєднують у собі властивості багатоатомних спиртів, карбонільних сполук та напівацеталей.
1. Для циклічних форм моноз найбільш характерні реакції за участю гідроксильної групи. Найбільш хімічно активна напівацетальна гідроксильна група.
Прості ефіри одержують при взаємодії гідроксильних груп моноз з алкілгалогенідами. Одночасно реакцію вступають як напівацетальна, так і спиртові гідроксигрупи. Напівацетальна група -ВІН більш реакційноздатна, тому утворення простого ефіру по цій групі протікає швидше і може протікати і при взаємодії моноз з нижчими спиртами у присутності хлороводню. Монефіри, що утворюються при цьому, називають глікозидами (піранозідами і фуранозідами).
Прості ефіри, утворені спиртовими гідроксильними групами, не гідролізуються, а глікозидний зв'язок легко піддається гідролізу в лужному середовищі. Розчини глікозидів не мутаротують.
Молекули етанолу або йодистого метилу виступають у цій реакції ролі нуклеофілів. Аналогічно монози взаємодіють з амінами та їх похідними з утворенням N-глікозидів.
Глікозиди є продуктами конденсації циклічних форм моносахаридів зі спиртами та амінами з утворенням глікозидного зв'язку. Глікозиди легко піддаються гідролізу у кислому середовищі. За типом О-глікозидів утворюються ді- і полісахариди, а за типом N-глікозидів – нуклеозиди – структурні компоненти нуклеїнових кислот. Глікозиди відіграють надзвичайно важливу роль у біохімічних процесах, зокрема у процесах дихання та фотосинтезу. Найважливіший з глікозидів – аденозинтрифосфат (АТФ), що є складним ефіром фосфорної кислоти та аденозину – нуклеозиду, що є продуктом конденсації аденіну з рибозою. Фосфатні групи АТФ виконують роль своєрідного енергетичного депо; при їхньому гідролізі виділяється енергія, необхідна клітинам для м'язового скорочення.
При взаємодії із кислотами та його ангідридами монози утворюють складні ефіри. Так, при взаємодії глюкози з оцтовим ангідридом утворюється пентаацетилглюкоза.
Біологічно важливий приклад реакції даного типу – реакція фосфорилювання. Фосфати – ефіри моноз та фосфорної кислоти містяться у всіх рослинних та тваринних організмах і являють собою метаболічно активні форми моносахаридів. Так, 1-фосфат D-глюкози утворюється при гідролізі глікогену (полісахариду, властивого тваринним організмам); 6-фосфат глюкози – продукт катаболізму глюкози в організмі; фосфати D-рибози та 2-дезокси-D-дезоксирибози - структурні елементи нуклеїнових кислот.
Реакція відбувається на першій стадії гліколізу (процесу окиснення глюкози в піруват). Слід зазначити, що це проміжні продукти гліколізу є складні ефіри моноз і фосфорної кислоти.
2. Окислення моноз у кислому та нейтральному середовищі призводить до утворення різних кислот. Окислення може піддаватися тільки карбонільна група - «м'яке» окислення, наприклад, бромною водою з утворенням -онових кислот
Окислення карбонільної та первинної гідроксильної групи - «жорстке» окиснення, наприклад, розчином HNO 3 до глікарових кислот.
Окислення тільки первинної гідроксильної групи у м'яких умовах (наприклад, при дії ферментів) при захисті альдегідної групи призводить до утворення глікуронових кислот.
Глікуроніди при нагріванні легко декарбоксилюються, що призводить до утворення моноз із меншим числом атомів вуглецю. Так можна отримати з D-глікуроніду пентозу – D-ксилозу.
Окислення моноз у лужному середовищі супроводжується деструкцією вуглецевого скелета. Реакції окислення характерні як для альдоз, але й кетоз (на відміну кетонів), що пояснюється явищем епімерізації моноз.
Окислення можуть піддаватися і деякі дисахариди, які називаються відновлюючими. Існуючи переважно у формі напівацеталей, вони мають потенційно вільну альдегідну групу (в оксо-формі).
Відновлювальні моно- і дисахариди відновлюють іони міді(П), що входять до складу реактиву Фелінга або до складу реактиву Бенедикта до оксиду міді (I) Сu 2 Про, а також іони срібла в реактиві Толленса OH до вільного срібла. Реакції використовують як якісні на наявність сахаридів, що відновлюють.
3. Моносахариди піддаються хімічному чи билогическому відновленню.
Відновлення моноз, як і будь-яких карбонільних сполук, призводить до перетворення карбонільних груп на спиртові; при цьому утворюються багатоатомні спирти, які називаються цукровими спиртами, або альдитами.
Крім амальгами натрію у водному (або водно-спиртовому, або спиртовому) середовищі для відновлення моноз використовують водень у присутності каталізаторів (Pt, Pd, Ni) та гідриди металів (особливо NaBH 4). Слід мати на увазі, що при відновленні альдоз утворюється один спирт, а при відновленні кетоз отримують два багатоатомних стеоізомерних спирту, т.к. неасимметричний 2-й атом С у кетоз (атом карбонільної групи) після відновлення стає асиметричним і можливі дві орієнтації гідроксильної групи, пов'язаної з ним.
4. Реакція ізомеризації (епімеризації) завжди відбувається за a-СН*-кислотним центром моносахаридів, яким є атом вуглецю, безпосередньо пов'язаний з карбонільною групою. Реакція протікає під дією розбавлених розчинів лугів або ферментативно (в умовах організму) та супроводжується
внутрішньомолекулярним окисненням-відновленням
(Диспропорціонуванням) атомів вуглецю С 1 і С 2 .
У ході цього перегрупування внаслідок перенесення
протона, що здійснюється під впливом
гідроксильного іона, виникає проміжне
з'єднання - ендіол (один подвійний зв'язок (-єн)
між двома гідроксильними групами (діол)).
Перетворення ендіолу можуть призвести до утворення.
нію як кетози, так і двох альдоз.
Таким чином, в результаті реакції
поступово утворюється рівноважна суміш
ізомерів. Наприклад, внаслідок епімерізації D-глюкози утворюється
D-манноза - епімер глюкози по 2 і D-фруктоза - структурний ізомер глюкози.
Приклад реакції ізомеризації в організмі - ферментативне перетворення глюкозо-6-фосфату на фруктозо-6-фосфат у процесі гліколізу.
Оліго- та полісахариди. Дисахариди (біози) є продуктом конденсації двох молекул моносахаридів, з'єднаних О-глікозидним зв'язком.
Якщо в реакції конденсації беруть участь обидва напівацетальні гідроксили і два залишки моноз з'єднуються глікозид-глікозидним зв'язком,утворюється невосстанавливающий дисахарид. Такий дисахарид не містить глікозидний гідроксил, не може переходити у відкриту альдегідну форму і тому не відновлює оксидів металів (не вступає в реакції з гідроксидом міді або реакцію «срібного дзеркала»).
Якщо в реакції конденсації беруть участь один напівацетальний та один спиртовий гідроксил та два залишки моноз з'єднуються глікозид-глікозним зв'язком,утворюється відновлюючий дисахарид. Такий дисахарид містить глікозидний гідроксил, рахунок якого може переходити у відкриту альдегідну форму і виступати як відновник.
Дисахариди, як і будь-які глікозиди, гідролізуються в кислому середовищі. Найбільш біологічно важливими дисахаридами є сахароза, мальтоза, лактоза та целобіоз.
Наприклад, структурну формулу мальтози, яка є основним продуктом розщеплення крохмалю в ротовій порожнині під дією ферменту слини - b-амілази, можна представити наступним чином:
Систематична назва (aD-глюкопіранозіл-(1®4)-aD-глюкопіраноза або 4-(aD- глюкопіранозидо)-D-глюко-піраноза) вказує на наявність глікозидного зв'язку між атомом С, що має a-конфігурацію, одного залишку глюкози і атомом С 4 іншого залишку. Мальтоза утворюється в результаті конденсації двох молекул a-D-глюкопіранози з утворенням глікозидного зв'язку між атомом 1 a-аномера глюкози і атомом 4 другої молекули глюкози. Такий зв'язок називають a(1®4)-зв'язком.
Лактоза (4-(b-D-галактопіранозідо)-D-глюкопіраноза) має будову:
Целлобіоз (4-(b-D-глюкопіранозидо)-D-глюкопіраноза) являє собою основний структурний елемент целюлози; утворюється при ферментативному гідроліз целюлози. Целлобіоз, як і лактоза, має 1,4-b-глікозидний зв'язок і є відновлюючим дисахаридом, але на відміну від лактози при повному гідролізі дає тільки D-глюкозу:
Сахарозу (a-D-глюкопіранозидо-b-D-фруктофуранозід)
називають тростинним цукром; вона є невосстанав-
ливающим дисахаридом, міститься в очереті, цукровій
буряках, різних фруктах, ягодах та овочах.
Систематична назва сахарози відображає конфігу-
рацію обох глікозидних (суфікс «озид» у назв обох
моноз) гідроксилів (a або b), та наявність зв'язку З 1 -З 2 .
Продукти конденсації кількох (від 2 до 12) молекул моносахаридів називають олігосахаридами; більшої кількості моносахаридів - полісахаридами.
Якщо макромолекули побудовані із залишків одного моносахариду, такі полісахариди називають гомополісахаридами. Серед гомополісахаридів найбільш біологічно важливими є полі-D-глюкопіранози: амілоза, амілопектин, глікоген (дисахаридним фрагментом останніх є мальтоза) та целюлоза, структурним компонентом якої виступає дисахарид целобіозу.
Амілоза – це полімер нерозгалуженої будови (лінійний полімер) молекулярною масою близько 60000; при нагріванні розчиняється у воді, утворюючи ліофільний колоїдний розчин; взаємодіє з йодом із заснуванням комплексного «з'єднання включення» синього кольору.
При ферментативному гідролізі b-амілазою, що виділяється підшлунковою залозою і міститься в слині, амілоза розщеплюється на глюкозу та мальтозу; гідроліз починається з невідновлювального кінця амілози та здійснюється послідовним відщепленням молекул мальтози.
Амілопектин має розгалужену структуру і включає поряд з a(1®4)-зв'язками та глікозидні a(1®6)-зв'язки. За рахунок останніх і утворюються розгалуження у структурі:
При розчиненні у воді амілопектин набухає, утворюючи пов'язанодисперсну систему - гель. З йодом амілопектин утворює поєднання червоно-фіолетового кольору.
Суміш амілози (20-25%) та амілопектину (75-80%) є полісахаридом природного походження - крохмаль.
Таким чином, природний крохмаль не є індивідуальною речовиною: він складається з двох фракцій, що відрізняються за будовою і внаслідок цього мають різну розчинність у теплій воді. Крохмаль є основним резервним полісахаридом рослин.
Крохмаль – біла аморфна речовина. У холодній воді не розчинний, у гарячій набухає та поступово розчиняється. При охолодженні виходить студнеподібна маса або гель (кисіль). За багатьма властивостями кисіль схожий на тверде тіло, зокрема, виявляє пружність, незважаючи на те, що це розбавлений розчин крохмалю, а не концентрований, як наприклад, сироп. Справа в тому, що при попаданні в розчин розгалужені і нерозгалужені молекули амілопектину і амілази за рахунок водневих зв'язків формують тривимірну просторову сітку, в комірки якої потрапляють молекули води. Такий каркас існує лише за невисокої температури. Якщо кисіль підігріти, молекули почнуть рухатися енергійніше, водневі зв'язки між ними руйнуватимуться і кисіль стане рідким.
Всі полісахариди крохмалю обертають поляризоване світло вправо, тому що утворені глюкозою. При нагріванні з кислотами крохмаль гідролізується за місцем глюкозид-глюкозних зв'язків, даючи послідовно декстрини, мальтозу та глюкозу.
Глікоген («тваринний крохмаль») за структурою та властивостями схожий на амілопектин, але має ще більш розгалужену полімерну ланцюг і є резервним полісахаридом тварин, що запасається в печінці та м'язовій тканині.
Глікоген є «двійником» крохмалю у тваринному світі і відіграє роль депоживних речовин та запасного вуглеводу тварин тканин (відкладається, в основному, у печінці та м'язах). Молекулярна маса глікогену дуже велика – близько 100 млн. Такий розмір молекул відповідає їхній біологічній функції резервного вуглеводу. Макромолекула глікогену через великий розмір не проходить через мембрану і залишається всередині клітини, доки не виникне потреба в енергії. У перервах між їдою глікоген потроху розщеплюється до глюкози, яка надходить у кров і потім використовується клітинами організму. У добре вгодованого дорослої людини запаси глікогену сягають 0,5 кг.
Одним із найважливіших полісахаридів є целюлоза. Вона утворює головну складову частину стінок рослинних клітин. Целюлоза є полімером, що повністю складається з ланок b-D-глюкопіранози, які пов'язані глікозидними b(1®4)-зв'язками.
Целюлоза - лінійний полімер, ланцюги якого можуть містити понад 10000 ланок:
Чиста целюлоза є білою волокнистою речовиною, нерозчинною у воді, ефірі або спирті. Така стійкість до розчинників пояснюється унікальною структурою целюлози.
Цей полісахарид складається з залишків D-глюкози, пов'язаних лише з глікозидним b(1®4)-зв'язком; молекули целюлози ниткоподібні та не мають розгалужень. Високоупорядкована структура, підтверджена даними рентгеноструктурного аналізу, обумовлює надзвичайну міцність і пружність целюлози, як і відсутність розчинності у більшості застосовуваних розчинників.
Цікаво, що целюлоза розчиняється в реактиві, приготованому змішуванням Сu(ОН) 2 з концентрованим водним розчином аміаку (реактив Швейцера), а також у підкисленому розчині ZnCl 2 при нагріванні або концентрованої сірчаної кислоти, тобто. у тих середовищах, склад яких обумовлює можливість розриву водневих зв'язків у молекулах целюлози та утворення нових зв'язків із розчинником.
Завдяки наявності вільних спиртових гідроксильних груп целюлоза здатна реагувати зі спиртами та кислотами з утворенням ефірів. Целюлоза виконує функції структурного полісахариду, використовуваного організмом для побудови кістяка клітинної тканини.
Пектинові речовини містяться в плодах та овочах, для них характерне желеутворення у присутності органічних кислот, що використовується у харчовій промисловості для виготовлення желе та мармеладів.
В основі пектинових речовин лежить
пектова - полігалактуронова кислота.
Пектова кислота складається із залишків
D-галактуронової кислоти, пов'язаних
a(1®4)-глікозидним зв'язком.
Деякі пектинові речовини мають противиразкову дію і є основою низки препаратів, наприклад, плантаглюцид із подорожника.
Гетерополісахариди(Макромолекули яких побудовані з залишків більш, ніж одного моносахарида) також досить широко поширені в природі.
Альгінові кислотимістяться у бурих водоростях. Нерозгалужена ланцюг побудована зі сполучених (1®4) зв'язками залишків D-маннуронової та L-гулуронової кислот. Альгінові кислоти як гелеутворювачі використовуються у харчовій промисловості. Морські водорості є джерелом багатьох полісахаридів. Наприклад, широко застосовуваний у біохімічних дослідженнях агарявляє собою гетерополісахарид, що містить велику кількість сульфатних груп. Агар складається із суміші агарози та агаропектину. У полісахаридного ланцюга агарози чергуються залишки D-галактози та L-лактози.
Полісахариди сполучної тканини. Сполучна тканина розподілена по всьому організму та обумовлює міцність та пружність органів, еластичність їх з'єднання, стійкість до проникнення інфекцій. Полісахариди сполучної тканини пов'язані з білками.
Найбільш повно вивчені хондроїтинсульфати(шкіра, хрящі, сухожилля), гіалуронова кислота(склоподібне тіло ока, пуповина, хрящі, суглобова рідина), гепарин(печінка). Ці Полісахариди мають спільні риси в будові: їх нерозгалужені ланцюги побудовані з дисахаридних залишків, до складу яких входять уронові кислоти (D-глюкуронова, D-галактуронова, L-ідуронова) і N-ацетилгексозаміни (N-ацетилгкоцецак). Деякі їх містять залишки сірчаної кислоти.
Гіалуронова кислота побудована з дисахаридних залишків, сполучених b(1®4)-глікозидними зв'язками. Дисахаридний фрагмент складається із залишків D-глюкуронової кислоти та N-ацетил-О-глюкозаміну, пов'язаних b(1®3)-глікозидним зв'язком. Гіалуронова кислота має велику молекулярну масу – 2-7 млн., розчини мають високу в'язкість, з чим пов'язують її бар'єрну функцію, що забезпечує непроникність сполучної тканини для патогенних мікроорганізмів.
Xондроїтинсульфати складаються з дисахаридних залишків N-ацетильованого хондрозину, сполучених b(1®4)-глікозидними зв'язками. До складу хондрозину входять D-глюкуронова кислота та D-галактозамін, пов'язані між собою b(1®3)-глікозидним зв'язком.
Сульфатна група утворює ефірний зв'язок з гідроксильною групою N-ацетил-О-галактозаміну, що знаходиться або в 4-му, або в 6-му положенні. Молекулярна маса хондроїтинсульфатів становить 10 000 - 60 000.
Хондроїтинсульфати та гіалуронова кислота містяться не у вільному, а у зв'язаному вигляді з поліпептидними ланцюгами.
ВИЗНАЧЕННЯ
Вуглеводи– органічні сполуки, що мають загальну формулу m H 2 n O n (n, m >3). Їх поділяють на три групи: моно-, оліго- та полісахариди.
ВИЗНАЧЕННЯ
Моносахариди- Вуглеводи, які не можуть гідролізуватися з утворенням більш простих вуглеводів (глюкоза, фруктоза).
Олігосахариди– вуглеводи, що є продуктами конденсації двох або декількох моносахаридів (цукрозу).
– вуглеводи, утворені великою кількістю молекул моносахаридів (крохмаль, пектин, целюлоза).
Моносахаріди. Глюкоза
Глюкоза (С 6 Н 12 Про 6) – це кристали білого кольору, солодкі на смак і добре розчинні у воді. Молекули глюкози можуть існувати в лінійній (альдегідоспірт з п'ятьма гідроксильними групами) та циклічній формі (α- та β-глюкоза), причому друга форма виходить з першої при взаємодії гідроксильної групи при 5-му атомі вуглецю з карбонільною групою (рис. 1).
Рис. 1. Форми існування глюкози: а) β-глюкоза; б) α-глюкоза; в) лінійна форма
Для вуглеводів, зокрема глюкози, характерні такі хімічні властивості:
1. Реакції, що протікають за участю карбонільної групи:
- глюкоза окислюється аміачним розчином оксиду срібла та гідроксидом міді (II) у глюконову кислоту при нагріванні
CH 2 OH-(CHOH) 4 -CH=O + Ag 2 O → CH 2 OH-(CHOH) 4 -COOH + 2Ag↓
CH 2 OH-(CHOH) 4 -CH=O + 2Cu(OH) 2 → CH 2 OH-(CHOH) 4 -COOH +Cu 2 O + H 2 O
- глюкоза здатна відновлюватися в шестиатомний спирт - сорбіт
CH 2 OH-(CHOH) 4 -CH=O +2[H] → CH 2 OH-(CHOH) 4 -CH 2 OH
- глюкоза не вступає в деякі реакції, характерні для альдегідів, наприклад, реакцію з гідросульфітом натрію.
2. Реакції, що протікають за участю гідроксильних груп:
- глюкоза дає синю фарбування з гідроксидом міді (II) (якісна реакція на багатоатомні спирти);
- Освіта простих ефірів. При дії метилового спирту однією з атомів водню заміщається на групу СН 3 . У цю реакцію вступає глікозидний гідроксил, що знаходиться при першому атомі вуглецю в циклічній формі глюкози

- Освіта складних ефірів. Під дією оцтового ангідриду всі п'ять груп -ВІН в молекулу глюкози заміщаються на групу -О-СО-СН 3 .
3. Бродіння:
- спиртове бродіння

- Молочнокисле бродіння
C 6 H 12 O 6 → 2CH 3 -CH(OH)-COOH
- маслянокисле бродіння
C 6 H 12 O 6 → C 3 H 7 COOH + 2H 2 + 2CO 2
Моносахаріди. Фруктоза
Фруктоза є ізомером глюкози. Як і глюкоза, вона може існувати в лінійній (кетоноспирт) та циклічній формі (рис. 1).

Рис. 1. Форми існування фруктози
Фруктоза входить у всі реакції, притаманні глюкози, проте, на відміну неї не входить у реакцію «срібного дзеркала».
ВИЗНАЧЕННЯ
Сахароза(C 12 H 22 O 11) – це біла кристалічна речовина, солодка на смак, добре розчинна у воді.
Молекула сахарози містить 2 цикли – 6-тичленний (залишок глюкози) та 5-тичленний (залишок фруктози), з'єднаних між собою за рахунок глікозидного гідроксилу глюкози:

Для сахарази характерна наявність наступних хімічних властивостей:
1. Гідроліз:
C 12 H 22 O 11 + H 2 O → C 6 H 12 O 6 (глюкоза) + C 6 H 12 O 6 (фруктоза)
2. Сахароза реагує із гідроксидом кальцію з утворенням сахарату кальцію.
3. Сахароза не вступає в реакцію «срібного дзеркала», тому її називають дисахаридом, що не відновлює.
ВИЗНАЧЕННЯ
Крохмаль- (З 6 Н 10 О 5) n - білий порошок, нерозчинний у холодній воді і утворює колоїдний розчин у гарячій воді.
Це природний полімер. Його молекули складаються з лінійних та розгалужених ланцюгів, що містять залишки α-глюкози. Фрагмент структури крохмалю виглядає так:

Крохмаль здатний гідролізуватися при нагріванні в кислому середовищі, причому кінцевим продуктом гідролізу є глюкоза:
Крохмаль дає інтенсивне синє фарбування з йодом – це якісна реакція на йод.
ВИЗНАЧЕННЯ
– (З 6 Н 10 Про 5) n – природний полімер, молекули якого складаються лише з лінійних ланцюгів, що містять залишки β-глюкози:

Для целюлози так само, як і для крохмалю, характерна здатність гідролізуватися при нагріванні в кислому середовищі:
(З 6 Н 10 О 5) n + nН 2 О → nC 6 H 12 O 6
Кожна структурна ланка молекули целюлози містить по три-ОН групи, які можуть реагувати з азотною та оцтовою кислотами з утворенням складних ефірів:
(C 6 H 7 O 2 (OH) 3) n + 3nCH 3 COOH → (C 6 H 7 O 2 (OCOCH 3) 3) n + 3nH 2 O
(C 6 H 7 O 2 (OH) 3) n + 3nHNO 3 →(C 6 H 7 O 2 (ONO 2) 3) n + 3nH 2 O
Приклади розв'язання задач
ПРИКЛАД 1
| Завдання | Отримана з глюкози сполука С 3 Н 6 Про 3 у реакції з натрієм утворює сполуку складу C 3 H 4 Na 2 O 3 з карбонатом кальцію - С 6 Н 10 СаО 6 з етанолом у присутності сірчаної кислоти - С 5 Н 10 Про 3 . Назвіть це з'єднання та напишіть рівняння реакцій |
| Рішення | При молочнокислому бродінні з глюкози виходить молочна (2-гідроксипропанова) кислота: З 6 Н 12 Про 6 → 2СН 3 -СН(ОН)-СООН. У реакції молочної кислоти з натрієм беруть участь і гідроксильна та карбоксильна групи: СН 3 -СН(ОН)-СООН + 2Na → CH 3 -CH(ONa)-COONa + H 2 З карбонатом кальцію та з етанолом молочна кислота реагує як звичайна карбонова кислота: СаСО 3 + 2СН 3 СН(ОН)СООН → (СН 3 СН(ОН)СОО) 2 Са + CO 2 + Н 2 О, СН 3 СН(ОН)СООН+С 2 Н 5 ОН → СН 3 СН(ОН)СООС 2 Н 5 +Н 2 Про. |