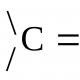Змішування двох обсягів газу із різною температурою. Змішування газів. Основи хімічної термодинаміки
13.7. Термотрансформатори
Найчастіше щодо технологічного процесу необхідно підтримувати певну температуру.
Найпростіший спосіб такої підтримки полягає в спалюванні палива та передачі теплоти від гарячих продуктів згоряння або безпосередньо споживачеві, або проміжного теплоносія. При цьому теплообмін відбувається природним шляхом від гарячого джерела із температурою Т 1 холоднішому з температурою Т 2 . При цьому способі більше теплоти, ніж отримане при згорянні палива, передати неможливо (а у зв'язку з втратами воно значно менше).
Однак принципово можливо, маючи деяку кількість теплоти q" за високої температури Т 1, отримати без витрати роботи більшу кількість теплоти при нижчій температурі Т 2 . Для цього достатньо здійснити оборотний прямий цикл Карно між джерелом з високою температурою та навколишнім середовищем з температурою Т з, в результаті якого буде отримано роботу (див. (7.7)):
Витративши цю роботу у зворотному оборотному циклі Карно між середовищем з температурою T зта споживачем з температурою Т 2 , передамо останньому кількість теплоти, що дорівнює
Підставивши в цей вираз значення роботи l зз попереднього виразу, отримаємо:

де коефіцієнт пропорційності ψ 1,2 називається коефіцієнтом перетворення теплотивід температури Т 1 до температури Т 2 .
Отже, отримавши q" кількості теплоти від джерела з температурою Т 1 можна передати тілу з температурою Т 2 кількість теплоти ψ 1,2 q" .
Так як Т 2 T 1 , то і q" >q" .
Наприклад, нехай t 1 = 1000 про З, t 2 = 50 про З, t з = 0 про С. Коефіцієнт. Таким чином, для того, щоб отримати, припустимо, 5 Дж теплоти при температурі 50 про С, слід витратити лише 1 Дж теплоти при 1000 про С, тоді як у звичайній опалювальній установці 1 Дж теплоти при високій температурі переходить в таку кількість теплоти при низької температури.
Отже, з погляду термодинаміки опалювальна установка в 5 разів менш економічна, ніж оборотна теплоперетворююча установка.
Пристрій, що дозволяє здійснювати прямий та зворотний цикли теплопередачі від джерела з однією температурою споживачу з іншою температурою, називається термотрансформатором.
Якщо потрібна температура нижча за вихідну, то термотрансформатор називається знижуючим.
Для підтримки вищої температури, ніж вихідна, потрібна допомога підвищуєтермотрансформатора, для якого , так як Т 2 > T 1 .
Рис. 13.7 Мал. 13.8
Термотрансформатор є поєднанням теплового двигуна і теплового насоса.
На рис. 13.7 представлена схема понижуючого термотрансформатора, а на рис. 13.8 – його теоретичний цикл.
На рис. 13.9 представлена схема термотрансформатора, що підвищує, а на рис. 13.10 – його теоретичний цикл.
На рисунках: І – тепловий двигун, ІІ – тепловий насос.
Якщо термотрансформатор призначений для підтримки температур і нижчих, і вищі, ніж вихідна, він називається термотрансформатором змішаного типу.
Рис. 13.9 Мал. 13.10
Контрольні питання
Як здійснюється зворотній цикл Карно?
Яким параметром оцінюється термодинамічна ефективність теплонасосної установки?
Чим відрізняються важливі схеми теплонасосних і холодильних установок?
14. Змішування газів та парів
У різних пристроях часто доводиться мати справу зі змішуванням різних газів, парів чи рідин. В цьому випадку потрібно визначити параметри стану суміші за відомими параметрами стану компонентів, що становлять цю суміш.
Вирішення цього завдання залежить від умов, за яких здійснюється цей процес змішування. Всі способи утворення сумішей можна розділити на три групи:
змішування газів при постійному обсязі,
змішування газових потоків,
змішування газів під час заповнення резервуара.
14.1. Процес змішування у постійному обсязі
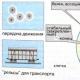
Цей спосіб утворення суміші полягає в тому, що кілька газів із тисками р 1 , р 2 , …, р n, температурами Т 1 , Т 2 , …, Т nта масами G 1 , G 2 , …, G nзаймають різні обсяги V 1 , V 2 , …, V n(Рис. 14.1).
Якщо прибрати перегородки, що роз'єднують між газами, то відбудеться змішання газів, причому обсяг суміші
V = V 1 + V 2 + …+ V n ,
а маса суміші
G = G 1 + G 2 + …+ G n .
При встановленні рівноважного стану параметри суміші будуть р, v, T, u.
Оскільки процес адіабатний та обсяг не змінився, то відповідно до першого початку термодинаміки зберігається внутрішня енергія системи:
U = U 1 + U 2 + …+ U nабо Gu = G 1 u 1 + G 2 u 2 + … + G n u n .
Звідси питома внутрішня енергія суміші визначається так:
![]() , (14.1)
, (14.1)
де g i- масова частка i-го газу.
А питомий обсяг за своїм визначенням дорівнює
![]() . (14.2)
. (14.2)
Інші параметри ( р, Т) для реальних газів, парів та рідин знаходяться з діаграм для цих речовин.
В окремому випадку, коли змішуються ідеальні гази з постійними теплоємностями, для яких du= c v dT, отримаємо
 У тому випадку, коли змішуються порції того самого газу, температура суміші обчислюється за більш простою формулою:
У тому випадку, коли змішуються порції того самого газу, температура суміші обчислюється за більш простою формулою:
![]() .
.
Тиск газу після змішування визначається за рівнянням Клайперона-Менделєєва
де R- газова стала суміші (визначена в розд. 1.4).
14.2. Процес змішування потоків
У цьому випадку змішування газів відбувається в результаті з'єднання кількох потоків в одному каналі.
Нехай трубопроводом 1 (рис. 14.2) до камери змішування надходить газ з параметрами p 1 , v 1 , T 1 , h 1 , а по трубопроводу 2 – газ із параметрами p 2 , v 2 , T 2 , h 2 .
Витрата газу через трубопровід 1 дорівнює G 1 , через трубопровід 2 – G 2 . На вході в камеру змішування ці газові потоки дроселюються для того, щоб тиск у камері рбуло менше, ніж р 1 та р 2 (якби, наприклад, р > р 1 , то газ з камери змішування кинувся б у трубопровід 1 ).
Слід наголосити, що тиск ру камері змішування може бути обрано різним (регулюванням вентилів); цим процес змішування в потоці істотно відрізняється від змішування в постійному обсязі, де тиск однозначно визначається параметрами газів, що змішуються.
З камери змішування газ із параметрами р, v, Tвідводиться трубопроводом 3 . Витрата газу у трубопроводі 3 , очевидно, дорівнює G = G 1 + G 2 .
Оскільки газ у трубопроводах рухається, то, крім внутрішньої енергії, він має (як ціле) ще й кінетичну та потенційну енергію. Для простоти (для більшості технічних завдань вона виправдана) вважатимемо, що
трубопроводи розташовані горизонтально, цим зміною потенційної енергією можна знехтувати;
швидкості переміщення газу щодо малі, тобто. зміною кінетичної енергією також знехтуємо.
Тоді згідно з першим початком для адіабатного потоку (9.3) за вищеперелічених умов маємо
Звідси отримаємо вираз для питомої ентальпії суміші, отриманої в результаті змішування в потоці:
![]() . (14.3)
. (14.3)
Знаючи питому ентальпію hта тиск ргазу після змішування, за допомогою діаграм стану можна знайти інші параметри суміші ( Т, v, sта ін.).
Для ідеальних газів, замінюючи питому ентальпію виразом з р Т, отримаємо
![]() . (14.4)
. (14.4)
У разі змішування двох потоків одного газу формула для температури суміші спрощується:
![]() . (14.5)
. (14.5)
Знаючи певну таким чином температуру Т, З рівняння стану для ідеального газу можна знайти питомий обсяг:
Формули (14.3)–(14.5) аналогічно записуються і для довільного числа потоків газів, що змішуються.
14.3. Змішування при заповненні обсягу
Нехай у резервуарі 1 (рис. 14.3) обсягом Vє газ (пар, рідина) масою G 1 з параметрами р 1 , Т 1 . У цей резервуар надходить трубопроводом 2 газ із параметрами р 2 , v 2 , Т 2 (очевидно, що р 2 > р 1) та масою G 2 після чого вентиль закривається. У резервуарі виходить суміш газів обсягом Vта масою G = G 1 + G 2 . Необхідно визначити параметри отриманої суміші.
У процесі заповнення відбувається робота проштовхування над газом у трубопроводі 2 , рівна – p 2 v 2 G 2; робота у резервуарі немає, оскільки обсяг резервуару постійний.
В адіабатному процесі робота здійснюється за рахунок зміни внутрішньої енергії (як і раніше кінетичною енергією газу, що витікає, нехтуємо з огляду на небагать швидкості течії):
Звідси питома внутрішня енергія суміші у посудині дорівнює
![]()
Питома кількість суміші за визначенням дорівнює v = V/ G.
Знаючи uі v, за допомогою діаграм знаходять інші параметри суміші ( р, Т, s, h).
У разі змішування одного і того ж ідеального газу з постійними теплоємностями
де k- Показник адіабати.
Тиск у резервуарі після змішування дорівнює
Змішуються дві порції повітря, причому маса першого компонента – 10 кг, яке температура – 400 про З, а маса другого компонента – 90 кг, а температура – 100 про З. Визначити температуру суміші при різних способах змішування.
Рішення: температура суміші в результаті процесу змішування при постійному обсязі або процес змішування в газовому потоці визначатиметься за формулою t = g 1 t 1 +g 2 t 2 . І в нашому прикладі дорівнює t= 0,1 ∙ 400 + 0,9 ∙ 100 = 130 про С.
Якщо суміш утворюється в результаті заповнення обсягу, в якому вже знаходиться перший газ, то її абсолютна температура обчислюється за формулою T = g 1 T 1 +kg 2 T 2 . У даному прикладі показник адіабати повітря k= 1,4 а температура суміші дорівнює t= 0,1 (400 +273) +1,4 ∙ 0,9 ∙ (100 +273) - 273 = 264 про С.
14.4. Зміна ентропії при змішуванні
Ентропія суміші є сумою ентропій складових цю суміш, тобто.
або у питомих величинах
Оскільки процес змішування – процес незворотний, то ентропія термодинамічної системи (все що у адіабатному змішуванні речовини) відповідно до другого початку термодинаміки у процесі буде зростати, тобто.
Необоротність процесу змішування пояснюється дифузією змішувальних компонент, що супроводжує цей процес. Збільшення ентропії у процесі змішування є мірою цієї незворотності.
Контрольні питання
Які відомі основні способи змішування?
Якими способами задається суміш?
Як визначити температуру суміші за різних способів змішування?
Чим пояснити, що при адіабатному змішуванні газів чи пари ентропія суміші збільшується?
15. Основи хімічної термодинаміки
Неоднорідна система визначається складом своїх компонентів. За певних умов цей склад може змінюватися за рахунок хімічних і фізико-хімічних перетворень, що відбуваються в системі, при яких відбувається руйнування старих і виникнення нових зв'язків між атомами. Ці процеси супроводжуються виділенням чи поглинанням енергії внаслідок дії сил цих зв'язків.
Хімічна термодинаміка розглядає застосування першого та другого початків термодинаміки до хімічних та фізико-хімічних явищ.
15.1. Хімічні реакції
Хімічна речовина– це макроскопічне тіло певного хімічного складу, тобто. тіло, щодо якого відомо не тільки, з яких хімічних елементів та в якій пропорції воно складається ( індивідуальна хімічна речовина), але також відомо, з яких сполук хімічних елементів воно утворене ( сумішабо розчин).
Хімічна речовина (сполука) зазвичай характеризується хімічною формулою, що показує, з яких елементів воно складається і в якому відношенні атоми цих елементів з'єднуються за її утворення.
Процеси взаємодії між окремими хімічними речовинами, що ведуть до утворення нових речовин, називаються хімічними реакціями.
Будь-яка хімічна реакція може відбуватися як у прямому, так і у зворотному напрямках.
У закритих системах хімічні реакції відбуваються так, що загальна кількість кожного з хімічних елементів, представлених у системі, не змінюється. З цієї причини у хімічних реакціях беруть участь не довільні кількості речовин, а стехіометричні їх кількості, тобто. кількості, що відповідають хімічним формулам речовин. Тому хімічні реакції записуються як рівностей між хімічними формулами що у реакції речовин і хімічними формулами продуктів цієї реакції. Нехай А 1 , А 2 , …, А n- вихідні речовини, а В 1 , В 2 , …, В m- Кінцеві продукти реакції. Тоді хімічна реакція між речовинами А 1 , А 2 , …, А n, що призвела до утворення речовин В 1 , В 2 , …, В m, запишеться у вигляді рівності:
в якому α 1 , α 2 , … α n, β 1 , β 2 … β m- Стехіометричні коефіцієнти. Наприклад, в результаті згоряння метану утворюється вуглекислий газ та вода:
СН 4 + 2О 2 = СО 2 + 2Н2О.
За одиницю кількості речовини в хімії приймається 1 міль. У цій кількості міститься суворо певна кількість молекул (атомів) даної речовини, що дорівнює постійній Авогадро N A= 6,02204∙10 23 . Іншими словами: 1 моль речовини визначається як така кількість речовини, маса якого в грамах дорівнює його молекулярній (атомній) масі М.
склад складних систем, утворених з багатьох речовин, кількість кожного з яких становить n iмолей, у хімії задається мольними часткамикомпонент системи.
1. Змішування газів при V=const. Якщо сумарний об'єм, займаний газами до і після змішування, залишається незмінним і гази до змішування займають об'єми V 1 , V 2 ,….. V n м 3 при тисках р 1 , р 2 , р n і температурах Т 1 Т n , а відношення теплоємностей цих газів з р/с v дорівнюють k 1 , k 2 ,…. k n то параметри суміші визначають за формулами:
температура
тиск
 (5.15)
(5.15)
Для газів, у яких мольні теплоємності рівні, а отже, рівні значення k, формули (62) і (63) набувають вигляду:
2. Змішування газових потоків. Якщо масові витрати потоків, що змішуються, рівні М 1 , М 2 , ... М n , кг / год, об'ємні витрати - V 1 , V 2 , ..... V n м 3 /год, тиску газів - р 1 , р 2 , р n і температури - Т 1, Т 2, ... Т n, а відносини теплоємностей окремих газів рівні відповідно k 1, k 2, .... k n то температури суміші визначають за формулою:
 (5.18)
(5.18)
Об'ємна витрата суміші в одиницю часу при температурі Т і тиску р:
 (5.19)
(5.19)
Для газів, які мають значення k рівні, температуру суміші визначають за формулою (64). Якщо газові потоки, крім однакових значень k, мають тиску, то формули (66) і (67) набувають вигляду:
 (5.21)
(5.21)
Завдання
5.1. Знайти зміну внутрішньої енергії 1 кг повітря при переході його від початкового стану t 1 = 300 0 С до кінцевого при t 2 = 50 0 С. Залежність теплоємності від температури прийняти лінійною. Відповідь дати у кДж.
Зміна внутрішньої енергії знайдено за формулою (5.9):
Du = З vm (t 2 -t 1).
Користуючись табл. 4.3, отримаємо для повітря
(З vm) 0 t =0.7084+0.00009349t кДж/(кг К);
(З vm) 50300 = 0.7084 +0.00009349 (50 +300) = 0.7411 кДж / (кг К).
Отже,
Du = 0.7411 (50-300) = - 185.3 кДж / кг
Відповідь: DU = - 185.3 кДж/кг
5.2. Знайти зміну внутрішньої енергії 2 м 3 повітря, якщо температура його знижується від t 1 =250 0 С до t 2 = 70 0 С. Залежність теплоємності від температури прийняти лінійною. Початковий тиск повітря Р1 = 0.6 МПа.
Відповідь: DU = -1063 кДж.
5.3. До газу, укладеного в циліндрі з рухомим поршнем, підводиться ззовні 100 кДж теплоти. Величина виконаної роботи при цьому становить 115 кДж. Визначити зміну внутрішньої енергії газу, якщо його кількість дорівнює 0.8 кг.
Відповідь: DU = - 18.2 кДж.
5.4. 2 м 3 повітря при тиску 0.5 МПа та температурі 50 0 З змішуються з 10 м 3 повітря при тиску 0.2 МПа та температурі 100 0 С. Визначити тиск та температуру суміші.
Відповідь: t см = 820С; Р см = 0.25 МПа.
5.5. У збірному газоході котельні змішуються гази трьох котлів, що йдуть, що мають атмосферний тиск. Для спрощення приймається, що це гази мають однаковий склад, саме: CO 2 =11.8 %; O 2 = 6.8%; N 2 = 75.6%; H2O=5.8%. Вартові витрати газів становлять V 1 =7100 м 3 /год; V 2 = 2600 м3/год; V 3 =11200 м 3 /год, а температури газів відповідно t 1 =170 0 С, t 2 =220 0 С, t 3 =120 0 С. Визначити температуру газів після змішування та їх об'ємні витрати через димову трубу при цій температурі.
Відповідь: t = 147 0; V = 20 900 м 3 /год.
5.6. Гази, що йдуть, з трьох парових котлів при тиску 0.1 МПа змішуються в збірному газоході і через димову трубу видаляються в атмосферу. Об'ємний склад газів, що йдуть, з окремих котлів наступний: з першого
СО 2 = 10.4%; Про 2 = 7.2%; N 2 = 77.0%; H2O=5.4%;
з другого
СО 2 = 11.8%; O 2 = 6.9%; N 2 = 75.6%; H2O=5.8%;
з третього
CO2 = 12.0%; O 2 = 4.1%; N 2 = 77.8%; H2O=6.1%.
Вартові витрати газів складають
М 1 = 12000 кг/год; М 2 = 6500 кг/год; М 3 = 8400 кг/год; а температури газів відповідно t1 = 1300С; t 2 = 1800С; t 3 = 2000С.
Визначити температуру газів після змішування в збірному газоході. Прийняти, що молярні теплоємності цих газів однакові.
Відповідь: t 2 = 164 0 З.
5.7. У газоході змішуються три газові потоки, що мають однаковий тиск, що дорівнює 0.2 МПа. Перший потік являє собою азот з об'ємною витратою V 1 =8200 м 3 /год при температурі 200 0 С, другий потік -двоокис вуглецю з витратою 7600 м 3 /год при температурі 500 0 С і третій потік - повітря з витратою 6400 м 3 / год при температурі 800 0 С. Знайти температуру газів після змішування та їх об'ємну витрату у загальному газопроводі.
Відповідь: t 1 = 423 0; V=23000 м3/год.
5.8. Продукти згоряння з газоходу парового котла в кількості 400 кг/год при температурі 900 0 С повинні бути охолоджені до 500 0 С та спрямовані на сушильну установку. Гази охолоджуються змішуванням газового потоку з потоком повітря при температурі 20 0 С. Тиск в обох газових потоках однаковий. Визначити годинну витрату повітря, якщо відомо, що R газ = R пов. Теплоємність продуктів згоряння прийняти рівною теплоємністю повітря.
Відповідь: М пов. = 366 кг/год.
Нехай в окремих термостатованих судинах під однаковим тиском p знаходяться гази Аі Ввзяті в кількостях емолей. При з'єднанні цих судин відбудеться мимовільне змішування газів до встановлення однорідного складу газової суміші по всьому обсягу системи. Припускатимемо, що вихідні гази та їх суміші підпорядковуються рівнянням стану ідеальних газів. Тоді за збереження постійного загального тиску газів p парціальні тиску газів в суміші, що утвориться, будуть рівні
При змішуванні ідеальних газів теплові ефекти відсутні, тому теплообміну між газами та термостатом не відбувається, і зміна ентропії системи повністю визначатиметься незворотністю процесів усередині системи.
Щоб знайти зміну ентропії, необхідно протиставити описаному мимовільному процесу уявний рівноважний перехід між тими ж початковим і кінцевим станами системи.
Для рівноважного змішування газів скористаємося спеціальним гіпотетичним пристроєм, за аналогією з термостатом, що називається хемостатом. . Цей пристрій складається з термостатованого циліндра, з переміщенням без тертя поршнем; на підставі циліндра знаходиться вибірково проникна для даної індивідуальної хімічної речовини мембрана; остання відокремлює індивідуальне речовина, завантажене в хемостат, від суміші речовин, що вивчається, що знаходиться в іншій посудині. На відміну від термостата, призначеного для підтримки заданої температури зануреного в нього тіла, або для нагрівання або охолодження останнього в рівноважному режимі, за допомогою хемостату забезпечують підтримання певного значення хімічного потенціалу даної індивідуальної речовини досліджуваної суміші речовин, а також рівноважне підведення та відведення речовини з суміші. Хімічний потенціал i -гохімічного компонента у хемостаті однозначно визначається температурою Tта тиском, створюваним на поршні. Змінюючи тиск на поршні, можна змінювати напрямок переходу даного компонента через селективну мембрану: якщо - хімічний потенціал компонента в досліджуваній суміші, то при речовина буде підводитися в суміш, при - виводитися з суміші, і при між хемостатом і сумішшю підтримується хімічна рівновага. Квазірівновага зміни складу суміші відповідає дифузійний перенесення речовини через мембрану під дією дуже малої різниці значень хімічного потенціалу по обидва боки мембрани.
Хімічний потенціал ідеального газу, незалежно від того, знаходиться цей газ в індивідуальному стані або в суміші з іншими ідеальними газами, виражається простим співвідношенням , де p iє або тиск чистого газу, або його парціальний тиск у суміші. Тому при перенесенні ідеального газу через напівпроникну мембрану рівновагу між сумішшю та хемостатом характеризується рівністю тиску в хемостаті та парціального тиску газу в суміші.

Рис. 2.3. Рівноважне змішування двох газів за допомогою хемостатів: a- Початковий стан системи; б- Стан системи після ізотермічного розширення газів; в- Кінцевий стан після змішування газів через мембрани; 1 – хемостати індивідуальних газів A та B ; 2 – напівпроникні мембрани; 3 - Посудина для рівноважного змішування газів.
Рівноважне змішування ідеальних газів Aі Bпроведемо в термостатованій системі, що складається з двох хемостатів індивідуальних компонентів Aі B, з'єднаних з третьою судиною – збіркою суміші, що утворюється, забезпеченим, так само як і хемостати, рухомим поршнем (рис. 2.3).
Нехай у початковий момент у хемостатах міститься відповідно молей компонента Aта молей компонента Bпід однаковим тиском p
; поршень у збірнику суміші знаходиться в нульовій позиції (обсяг газу під поршнем дорівнює нулю). Процес змішування проводимо у два етапи. На першому етапі здійснюємо оборотне ізотермічне розширення газів. Aі B; при цьому тиск Aзнижуємо від p
до заданого тиску та тиск Bвідповідно від p
до. Обсяги, що займаються газами в першому та в другому хемостатах, зміняться відповідно від до та від до . Робота, виконана газом, що розширюється, в першому хемостаті, дорівнює ![]() ; у другому
; у другому ![]() . Таким чином, на першому етапі в нашому гіпотетичному пристрої проводиться сумарна робота. Оскільки при ізотермічному розширенні ідеального газу його внутрішня енергія не змінюється, вказана робота здійснюється за рахунок еквівалентного підведення теплоти з термостата. Звідси оборотна зміна ентропії в системі буде рівна
. Таким чином, на першому етапі в нашому гіпотетичному пристрої проводиться сумарна робота. Оскільки при ізотермічному розширенні ідеального газу його внутрішня енергія не змінюється, вказана робота здійснюється за рахунок еквівалентного підведення теплоти з термостата. Звідси оборотна зміна ентропії в системі буде рівна
На другому етапі процесу (власне змішування) робимо перепускання газів з хемостатів через селективні мембрани в збірник суміші шляхом синхронізованого руху трьох поршнів. При цьому на кожному з поршнів підтримується постійний тиск, відповідно, і в хемостатах і в збірнику, що забезпечує рівноважний перехід газів через мембрани (точніше, у збірнику створюється тиск трохи менший. p , Зберігаючи відмінну від нуля рушійну силу дифузії через мембрани). Оборотність процесу змішування в даному випадку забезпечується можливістю синхронної зміни напрямку руху всіх трьох поршнів, що призводило б до зворотного поділу суміші на індивідуальні компоненти. Після завершення операції суміш, очевидно, займе у збірнику об'єм .
Оскільки у разі ідеальних газів змішування не супроводжується будь-яким тепловим ефектом, теплообмін нашого пристрою з термостатом на другому етапі операції відсутня. Отже, зміна ентропії системи цьому етапі немає, .
Корисно переконатись шляхом прямого підрахунку, що робота газів на другому етапі дорівнює нулю. Дійсно, на переміщення поршнів в хемостатах витрачається робота, в той же час у збірнику газами проводиться та сама за величиною робота. Звідси.
Отже, сумарний приріст ентропії при змішуванні газів визначається виразом (2.9), . Якщо при рівноважному варіанті змішування цей приріст пов'язаний із зворотним підведенням теплоти та виробництвом еквівалентної кількості роботи ![]() , то при прямому (незворотному) змішуванні газів цей же приріст ентропії відбувається за рахунок її генерації всередині системи; ніякої роботи система при цьому не робить.
, то при прямому (незворотному) змішуванні газів цей же приріст ентропії відбувається за рахунок її генерації всередині системи; ніякої роботи система при цьому не робить.
Після підстановки (2.8) вираз (2.9) можна переписати як
 . (2.10)
. (2.10)
Цьому співвідношенню відводиться обов'язкове місце в курсах термодинаміки через його парадоксальності. Примітно, що зміни ентропії (при змішуванні ідеальних газів!) немає значення, що із чим змішується, і навіть при яких тиску і температурі. Фактично тут наведено неформальний висновок (2.10).
Доповнимо висновок (2.10) його корисними наслідками. Вводячи молярні частки компонентів ![]() і , отримаємо вираз для зміни ентропії в розрахунку на 1 моль суміші, що утворюється:
і , отримаємо вираз для зміни ентропії в розрахунку на 1 моль суміші, що утворюється:
![]() . (2.11)
. (2.11)
Максимум цієї функції посідає еквімолярну суміш газів, 0.5.
З погляду теорії поділу сумішей речовин цікавить простежити зміна виробництва ентропії при додаванні досить великої кількості молей компонента Bдо одного благаю компонента A. Вважаючи в (2.10) і , отримаємо
При виведенні (2.12) використовувалося математичне подання логарифмічної функції
 .
.
Формула (2.12) показує, що послідовне розведення суміші супроводжується нескінченним зростанням ентропії з розрахунку на моль домішкового компонента.
Формула (2.10) дає інтегральну величину збільшення ентропії при змішуванні кінцевих кількостей газу. Для того, щоб прийти до компактного диференціального виразу, аналогічного формулі (2.7) для теплообміну, видозмінимо модель змішування компонентів (див. рис. 2.4). Припускатимемо, що змішання відбувається через проникну для обох компонентів мембрану, або через досить вузький вентиль, що розділяють судини, заповнені сумішами Aі Bрізного складу. Система термостатована, і в обох судинах за допомогою поршнів підтримується постійний тиск p . При обмеженій швидкості змішування склад суміші у кожному з судин може вважатися однорідним за обсягом судини. Таким чином, дана система аналогічна теплообмінній системі із слабопровідною перегородкою.
Нехай змішуються n хімічно невзаємодіючих між собою ідеальних газів. Передбачається, що відомі початкові термодинамічні параметри стану всіх компонентів до змішування та умови змішування (умови взаємодії з навколишнім середовищем). Потрібно знайти рівноважні параметри стану газів після змішування
Розглянемо два випадки змішування, для простоти вважаючи, що цей процес триває без теплообміну з навколишнім середовищем .
2.1. Змішування при W=Const
У цьому випадку умови змішування такі, що обсяг суміші, що утворюється Wсм дорівнює сумі початкових обсягів компонентів суміші W H i:
(Не слід плутати W H iз парціальними обсягами W i, розглянутими у параграфі 1.4.3.)
Позначимо:
Р H i- Початковий тиск i-го газу;
Т H i,t H i- Початкова температура i-го газу відповідно до 0 Доабо 0 З.
Т.к. вся система з nгазів при змішуванні в умовах W=Constне здійснює зовнішньої роботи, то відповідно до першого початку термодинаміки для цього випадку () можна записати:
Тут: Uсм – внутрішня енергія суміші газів масою mсм кілограмів
з температурою Т 0 К;
U H i- внутрішня енергія i-го газу масою m iкілограмів
з початковою температурою Т H i .
Введемо позначення:
uсм – питома внутрішня енергія суміші газів за нормальної температури Т 0 К;
u H i -питома внутрішня енергія i-го газу з початковою температурою Т H i .
Тоді рівняння (2.1.1) набуває такого вигляду:
(2.1.2)
Як відомо, для ідеального газу du=C v dTзвідки при відліку внутрішньої енергії від 0 0 Доможна записати:
Тут: - Середня в діапазоні 0 Т 0 Кмасова ізохорна теплоємність суміші газів;
Середня у діапазоні 0 Т H i 0 Кмасова ізохорна теплоємність i-го газу.
Після підстановки (2.1.3) (2.1.2) отримаємо:
Але відповідно до параграфа 1.4.10 справжня масова теплоємність суміші газів виражається через масові частки компонентів g iта їх справжні теплоємності наступним чином:
Аналогічно середня в діапазоні 0 Т 0 Кмасова ізохорна теплоємність суміші газів визначиться як:
Підставляючи цей вираз у ліву частину рівняння (2.1.4) отримаємо:
звідки (2.1.5)
Т.к. з рівняння стану , то після підстановки m iдо рівняння (2.1.5) остаточно отримаємо формулу для температури суміші nгазів:
Як відомо, тому формула (2.1.6) може бути записана в наступному вигляді:
(Слід нагадати, що твір - це середня в діапазоні 0- Т H i 0 Кмолярна ізохорна теплоємність i-го газу.)
У довідковій літературі емпіричні залежності теплоємності від температури часто даються для діапазону 0 t 0 С .
Після підстановки (2.1.8) та (2.1.9) до рівняння (2.1.2) отримаємо:
Замінюючи m iйого значенням остаточно отримаємо формулу для температури суміші газів у градусах Цельсія :
Висловлюючи R iчерез молекулярну масу отримаємо ще одну формулу:
У знаменниках формул (2.1.6), (2.1.7), (2.1.10) та (2.1.11) містяться середні теплоємності, у яких як верхня межа опосередкування використовується температура суміші ( tабо Т), що підлягає визначенню. В силу цього температура суміші за цими формулами визначається методом послідовних наближень .
2.1.1. Приватні випадки змішування газів при W=Const
Розглянемо кілька окремих випадків формул (2.1.6), (2.1.7), (2.1.10) і (2.1.11).
1. Нехай змішуються гази, у яких залежністю показника адіабати До iвід температури можна знехтувати.
(Насправді Дозменшується зі зростанням температури, т. до.
де сор , а- Емперичні позитивні коефіцієнти.
Для технічних розрахунків у діапазоні від 0 до 2000 0 С можна скористатися такими формулами:
а) для двоатомних газів До 1,40 - 0,50 10 -4 t;
б) для продуктів згоряння До 1,35 - 0,55 10 -4 t.
З цих формул видно, що вплив температури на показник адіабати Достає помітним лише при температурах, близько сотень градусів за шкалою Цельсія.
Т. о., якщо припустити, що
то формула (2.1.6) набуде наступного вигляду:
Формулу (2.1.12) можна використовувати як перший наближення для формул (2.1.6), (2.1.7), (2.1.10) та (2.1.11)
2. Нехай змішуються гази, у яких мольні ізохорні теплоємності рівні і залежністю цих теплоємностей від температури можна знехтувати, тобто:
Тоді рівняння (2.1.7) набуває дуже простого вигляду:
Якщо у газів рівні між собою молярні ізохорні теплоємності, то відповідно до рівняння Майєра
повинні бути рівні між собою і мельні ізобарні теплоємності, а, отже, рівні показники адіабати, тобто.
При цій умові рівняння (2.1.12) перетворюється на (2.1.13).
2.1.2. Тиск після змішування газів при W=Const
Тиск, що встановлюється після змішування газів, можна визначити або за формулами параграфа 1.4.2, або за умови:
Рсм Wсм = mсм Rсм Т= mсм Т.
Уявимо собі три горизонтальні шари А, В і С нашого газового стовпа, причому шар розташований вище А, а А - вище С. Завжди можливо отримати будь-яку кількість суміші складу А, змішавши деякий об'єм із шару З з об'ємом із шару В. Назад, будь-яку кількість суміші складу А можна розкласти на дві суміші зі складом і С.
Це змішування та поділ двох газів можна здійснити і оборотним шляхом, зміцнивши в А, В та С горизонтальні труби. Той кінець кожної такої труби, що виходить із газового стовпа назовні, закривається поршнем. Будемо тепер у шарах В і С всувати поршні всередину, рухаючи їх, скажімо, зліва направо, а в точці А, навпаки, висуватимемо поршень назовні, тобто справа наліво. Тоді В і С деякі маси газу підуть зі стовпа, а А, навпаки, надійде якийсь обсяг суміші. Ми приймемо, що в кожній такій трубі міститься деяка маса суміші того самого складу, що і горизонтальний шар газового стовпа, з яким повідомляться дана труба.
![]()
Значення визначаться тоді із рівнянь
Звідси слідує що
![]()
Розділимо тепер суміш якимось оборотним шляхом і підрахуємо витрачену роботу.
Введемо в А одиницю обсягу суміші, а з і виведемо, відповідно, обсяги
Вся робота, витрачена у цьому процесі, дорівнює
підставляючи сюди значення, бачимо, що ця робота дорівнює нулю.
Тут є деяка тонкість: суміші і на які розпалася суміш А, підняті на різну висоту і придбали, таким чином, різну потенційну енергію. Але якщо робота дорівнює нулю і температура системи постійна, це можливо лише в тому випадку, якщо система віддала або отримала деяку кількість теплоти. Знаючи зміну потенційної енергії, знайдемо кількість теплоти, повідомлену системі, а звідси і зміну ентропії.
Приріст потенційної енергії складе
але воно дорівнює кількості теплоти, повідомленому системі, так що збільшення ентропії буде одно
На таку величину сума ентропій обсягу суміші і обсягу суміші С більше ентропії одиниці обсягу суміші А. Звідси можна знайти обсяги сумішей В і С, сума ентропій яких дорівнює ентропії одиниці обсягу суміші А; для цього доведемо обсяги сумішей В і З оборотним ізотермічним шляхом до обсягів та суму прирощень ентропій обох сумішей при цьому процесі прирівняємо виразу (75), взятому зі зворотним знаком.
Прирощення ентропії для суміші складе
![]()
![]()
Підставимо в рівняння (76) вираз для тисків через щільність